- Accueil
- Actualités
- InfoVac
- Vaccins
- Les vaccins
- Disponibilité des vaccins
- Maladies que l'on peut éviter
- Coqueluche
- Covid-19
- Diphtérie
- Fièvre jaune
- Fièvre typhoïde
- Grippe
- Haemophilus influenzae b
- Hépatite A
- Hépatite B
- HPV - Cancer de l'utérus
- Méningocoques
- Méningoencéphalite à tiques
- Oreillons
- Pneumocoques
- Poliomyélite
- Rage
- Rotavirus
- Rougeole
- Rubéole
- Tétanos
- Tuberculose
- Varicelle
- Variole du singe
- VRS
- Zona
- Pratiques vaccinales
- Formation en vaccinologie
- Administration des vaccins par voie IM
- Prévenir la phobie des vaccins/piqûres
- Trucs et astuces en vaccination pédiatrique
- Rattrapage des vaccinations chez l'enfant et l'adulte
- Interchangeabilité des vaccins
- Contre-indications vaccinales
- Vaccination des femmes enceintes
- Vaccination du prématuré
- Vaccination des adolescents
- Le sein plus les vaccins, c’est plus malin
- Effets secondaires des vaccins
- Déclaration des ES
- Hésitation Vaccinale
Vaccins par maladie
- Les vaccins
- Disponibilité des vaccins
- Maladies que l'on peut éviter
- Coqueluche
- Covid-19
- Diphtérie
- Fièvre jaune
- Fièvre typhoïde
- Grippe
- Haemophilus influenzae b
- Hépatite A
- Hépatite B
- HPV - Cancer de l'utérus
- Méningocoques
- Méningoencéphalite à tiques
- Oreillons
- Pneumocoques
- Poliomyélite
- Rage
- Rotavirus
- Rougeole
- Rubéole
- Tétanos
- Tuberculose
- Varicelle
- Variole du singe
- VRS
- Zona
Abécédaire des questions-réponses les plus fréquentes sur la vaccination COVID-19
La pandémie Covid-19 causée par le SARS-CoV-2 a stimulé le développement de vaccins efficaces qui ont été produits à une vitesse sans précédent grâce à l'utilisation de nouvelles technologies. Aucune alerte de sécurité majeure, hormis de rares cas d'anaphylaxie, n'avait été mise en évidence lors des premiers essais qui ont concerné des dizaines de milliers d'adultes et le risque d'effets indésirables graves est resté remarquablement faible après la vaccination de plus de 6 milliards de personnes dans le monde. Il n'est pas surprenant que des rapports de réactions exceptionnelles soient maintenant décrits à mesure que le nombre d’individus vaccinés augmente : Pour les vaccins à ARNm, les myocardites et péricardites semblent l’effet indésirable le plus caractéristique. Les décisions gouvernementales (passe-sanitaire quasi généralisé et obligations vaccinales pour l’ensemble des soignants, pompiers, policiers…) ont abouti à ce que la proportion de Français vaccinés est aujourd’hui devenue une des meilleure du monde : près de 80 % de l’ensemble des Français, > 90 % des plus de 18 ans et plus de 80% des adolescents. Le talon d’Achille reste cependant une couverture vaccinale encore insuffisante des plus âgés (>80 ans) et d’autres groupes à risque qui ne dépasse pas celle des autres tranches de la population, ce qui nous rend vulnérables face aux vagues épidémiques successives expose à un risque de mortalité importante. L’émergence de variants plus contagieux doit conduire à des couvertures vaccinales très élevées si l’on veut réduire le risque de voir se développer une surcharge hospitalière et de nombreux décès. Après le variant largement prédominant en France comme dans toute l’Europe en début d’année 2021, c’est entre juin et décembre 2021 que les variants ∂ sont devenus largement prédominants: ils étaient 50 à 60% plus contagieux que le variant alpha déjà 50 à 60% plus contagieux que les souches historiques. Fin décembre 2021, les variants Omicron encore plus contagieux et plus résistant à l’immunité que le ∂ sont devenus prédominants.
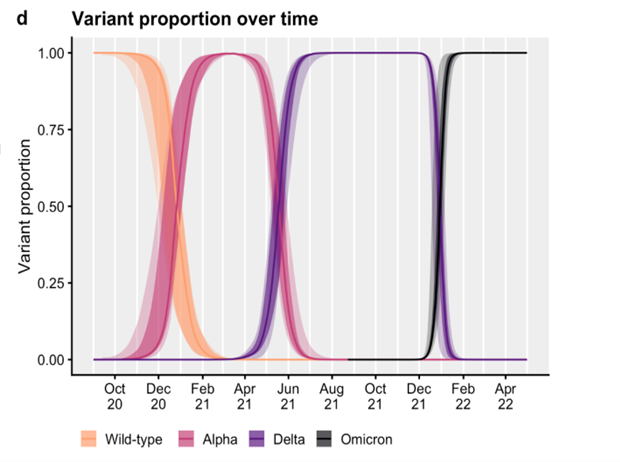
En un an, le R0 est passé d’une valeur entre 2,5 et 3 à une valeur supérieure à 10 s’approchant du R0 maximal connu pour les maladies infectieuses : la rougeole. Les variants ∂ restaient sensibles aux vaccins disponibles pour les formes graves (>90%), mais 2 doses étaient nécessaires et une baisse de l’efficacité dans le temps était observée pour les formes moins sévères et la transmission. Cependant, des formes graves avaient été rapportées chez des sujets, essentiellement âgés avec comorbidités, ayant reçu deux doses de vaccins, ceci suscitant la nécessité d’un booster au moins pour les plus fragiles. Les variants Omicron changent la donne par leurs plus grandes transmissibilités, et leurs résistances à l’immunité acquise par infection naturelle (par la souche ancestrale ou un autre variant) ou par la vaccination. La primovaccination confère une protection contre l’infection, modeste et peu durable (quelques semaines), mais est considérablement améliorée (pendant quelques semaines ou mois) par le rappel. En revanche, l’immunité cellulaire, moins dépendante des mutations sur la zone RBD (Receptor Binding Domain) maintient une protection contre les formes graves. La grande transmissibilité des variants Omicron qui plaide pour une plus forte transmission « air », fait que les enfants ont été très largement touchés quel que soit leur âge. Jamais, depuis le début de la pandémie, le nombre d’hospitalisations pédiatriques pour COVID n’avait été aussi élevé. Cependant l’immense majorité des cas pédiatriques sont des formes extrêmement bénignes et depuis fin Février 2022, la vague Omicron reflue rapidement tant chez l’adulte que chez l’enfant, sans vague de PIMS secondaire significative. La levée des mesures d’hygiène, y compris du masque à l’école et de l’utilisation du passe sanitaire et vaccinal d’ici quelques jours, en sont les témoins.
Au 10 Mars 2022
- Dans le monde, plus de 5 milliards de personnes (plus de 60% de la population globale) ont déjà reçu au moins une dose de vaccin et 3 milliards, 2 doses.
En France, plus 54 millions de personnes ont reçu au moins une injection, soit 80% de l’ensemble de la population (90% des plus de 18 ans), plus de 52 millions (78 %) ont reçu 2 doses, près de 40 millions (60%) la dose de rappel (https://solidarités-santé). Plus de 84 % des 12-17 ans ont reçu une 1ère dose, 82% le schéma complet. Alors que le taux de couverture vaccinale avec une dose a atteint 96 % chez les 70-79 ans, environ 10 % des 80 ans et plus n’ont pas encore reçu une seule injection…
Plusieurs vaccins contre la COVID-19 ayant obtenu l’AMM (AstraZeneca, Johnson&Johnson) ou en cours d’évaluation Européenne (Spoutnik V, Cansino) utilisent des adénovirus (simiens ou humains modifiés) comme vecteurs. S’agit-il de vaccins vivants et ont-ils les mêmes contre-indications que les vaccins vivants (immunodépression, grossesse…) ? Non !!! La souche modifiée d’adénovirus de ces vaccins est incapable de se répliquer. Ces vaccins ne peuvent pas être considérés comme des vaccins vivants. Ils induisent une immunité contre le SARS-CoV-2 en pénétrant dans les cellules où ils délivrent la séquence nécessaire à la production de la protéine S qui sera exprimée à la surface de la cellule (comme les vaccins à ARNm), sans risque de modification des gènes. Cependant, une immunité contre les autres antigènes de l’adénovirus vecteur est aussi déclenchée soit par les antigènes présents à la surface des virions injectés, soit par l’expression des gènes de ces protéines dans les cellules (comme pour le spike). Ceci pourrait limiter le nombre de virus capables de rentrer dans les cellules lors de la deuxième dose et diminuer la production de l’antigène du spike. Ceci pourrait expliquer en partie pourquoi lorsqu’elle est administrée trop tôt (…avant 10 semaines), la seconde dose a moins d’efficacité et le fait que le vaccin anti-COVID-19 soit le seul vaccin pour lequel la deuxième dose est mieux tolérée que la première. C’est pour éviter ce type de phénomène - que l’on peut rapprocher de l’effet « blunting » pour la vaccination coqueluche ou la grippe - que le vaccin Spoutnik V comporte un adénovirus différent pour chacune des deux doses. Cependant, le vaccin russe n’est pas encore homologué en Europe, ni par l’OMS, non pas tant pour des raisons d’efficacité, mais de qualité de transparence des résultats et de la surveillance de la pharmacovigilance. En effet, alors qu’un effet indésirable rare mais grave (thromboses atypiques cérébrales, splanchniques, diffuses avec thrombopénie) a été décrit pour les deux autres vaccins vectorisés AstraZeneca & Johnson&Johnson, rien n’est rapporté pour le Spoutnik…à suivre
Les vaccins contre la COVID-19 contiennent-ils des adjuvants ? Non !!! Ni les vaccins à ARNm ni les vaccins vectorisés viraux n’en contiennent, ils n’en ont pas besoin pour stimuler l’immunité. Parmi les vaccins en fin de développement et bientôt disponibles, celui de Novavax, vaccin protéique, sous-unitaire recombinant à nanoparticules en contient (Matrix M, dérivé de la saponine). C’est également l’approche développée par Sanofi Pasteur et GSK (AS03).
Dispose-t-on de données d’immunogénicité, d’efficacité et de tolérance chez les adolescents ? Oui !!! Pour les 2 vaccins à ARNm. Pfizer-BioNTech (Comirnaty®) a réalisé une étude chez des adolescents de 12 à 15 ans. Cette étude vaccin versus placebo, comportant 2 260 adolescents, outre une bonne tolérance, n’a retrouvé aucun cas de COVID-19 chez les vaccinés vs 18 cas dans le groupe contrôle et l’EMA a octroyé une AMM conditionnelle mi-mai. Mi-Juillet L’EMA a accordé aussi une extension d'indication pour le vaccin Spikevax® (Moderna) aux adolescents âgés de 12 à 17 ans sur la base d’une étude publiée maintenant, portant sur 3 732 sujets : aucun des 2 163 enfants ayant reçu le vaccin n'a développé de COVID-19, contre 4 des 1 073 enfants ayant reçu le placébo. Les effets secondaires étaient similaires à ceux observés chez les personnes âgées de 18 ans et plus : la douleur et le gonflement au point d'injection, la fatigue, les maux de tête, les douleurs musculaires et articulaires, l'hypertrophie des ganglions lymphatiques, les frissons, les nausées, les vomissements et la fièvre. Ces effets étaient généralement considérés comme légers à modérés et s'amélioraient en quelques jours après la vaccination. Dans l’étude Spikevax® (le plus dosé des deux vaccins à ARNm), la réponse Ac a été comparable à celle observée chez les jeunes adultes de 18 à 25 ans. Par contre, dans l’étude Pfizer, l’immunogénicité s’est révélée 1,6 fois supérieure à celle des sujets de 16 à 25 ans, cette meilleure immunogénicité de l’adolescent étant déjà connue pour de nombreux vaccins (Hépatite B, Papillomavirus, Hépatite A), autorisant des schémas vaccinaux comportant moins de doses pour eux.
Faut-il vacciner les adolescents contre la COVID-19 ? Oui !! D’autant plus que le variant ∂ est devenu prédominant en France, que les adultes sont déjà bien vaccinés et que l’on a une évaluation plus complète de la sécurité des vaccins dans cette tranche d’âge. En effet, outre le bénéfice collectif attendu (les adolescents sont plus souvent infectés et plus souvent infectants que les enfants), un bénéfice individuel net est escompté ne concernant pas tant le risque de COVID grave ou prolongée (en France…) mais le retour à une vie et une scolarité la plus « normale » possible. Les adolescents développent moins de formes graves de la Covid-19 qui ont occasionné, d’après Santé Publique France, environ 2000 hospitalisations, 300 admissions en soins critiques et 130 PIMS. La majorité des formes sévères chez les adolescents est associée à la présence d’une comorbidité (entre 45 à 75% des cas selon les études). En revanche, les fermetures de classes ou d’établissements liées à la circulation du virus ont un impact particulier et important sur les adolescents. Le gouvernement français a ouvert la vaccination à tous les adolescents (à partir de 12 ans) à compter du 15 Juin. Cette mesure allait initialement au-delà de l’avis de la HAS, du comité d’éthique, des pédiatres et des infectiologues. En effet, la HAS recommandait de vacciner très rapidement les adolescents présentant une comorbidité ou vivant dans l’entourage de personnes immunodéprimées, puis de vacciner les adolescents en bonne santé dès lors que la vaccination de la population adulte sera suffisamment avancée. L’émergence du très contagieux variant ∂ et des données de pharmacovigilance dans cette tranche d’âge plus robustes (venant des États-Unis et d’Israël et comportant plusieurs millions d’adolescents) permettent aujourd’hui de mieux apprécier le rapport bénéfices/risques. L’ensemble des sociétés savantes pédiatriques a opté pour une position claire en faveur de la vaccination des adolescents prenant en compte le risque de myocardites-péricardites aiguës chez le garçon après la deuxième dose. Enfin, une étude en Israël montre que la vaccination des adolescents les protège dans les premiers mois à plus de 90% de l’infection à SARS-CoV-2 (toutes formes confondues) par le variant ∂ après 2 doses. Les dernières données d’incidence et d’hospitalisation de Santé Publique France montrent que pour la première fois d’octobre à décembre 2021, les courbes de l’enfant et de l’adolescents se dissocient avec moins de cas et d’hospitalisations chez l’adolescent (très majoritairement vacciné) que chez l’enfant (non immunisé). Enfin, une étude Française, montre que parmi la trentaine de cas de PIMS survenus ces derniers mois, aucun n’est survenu chez des adolescents ayant reçu 2 doses alors que la couverture vaccinale atteignait 73%.
Quelle(s) aiguille(s) faut-il utiliser pour la vaccination contre la COVID-19 ? Ces vaccins bien que quasiment indolores à l’injection entrainent assez fréquemment des réactions locales. La meilleure façon de les prévenir est de bien injecter en intramusculaire. Pour cela l’injection doit se faire à 90°, sans pincer la peau mais au contraire en la tendant, et le choix de l'aiguille repose sur son diamètre et sur sa longueur. Le diamètre le plus fin est en principe le moins douloureux. La longueur pour une injection en IM dans le deltoïde doit au moins être de 25 mm pour un sujet de corpulence moyenne. Toutefois, cette longueur doit être adaptée à chaque individu et il ne faut pas à hésiter à utiliser des aiguilles plus longues si nécessaire.
Peut-on vacciner une femme qui allaite ? Oui !!! Comme les femmes enceintes, les femmes allaitantes (bien que les vaccins anti-Covid ne soient pas des vaccins vivants et les risques théoriques apparaissaient comme peu plausibles), avaient été exclues des études cliniques initiales et de ce fait il n’existait pas de données spécifiques les concernant au moment de la mise sur le marché des vaccins. Depuis, des données ont été publiées chez la femme enceinte et allaitante, démontrant la bonne tolérance, l’immunogénicité, et le passage des anticorps dans le sang du cordon et le lait. Des anticorps apparaissent dans le lait de mère dès le 7e jour. Ceci laisse augurer d’un certain degré de protection des nouveau-nés et des petits nourrissons. Le CRAT n’identifie aucun risque particulier et l’OMS recommande de ne pas interrompre l’allaitement. Une femme allaitante doit être vaccinée.
Les personnes allergiques peuvent-elles se faire vacciner avec ces vaccins contre la COVID-19 et notamment avec ceux à ARNm ? Dans l’immense majorité des cas OUI !!! Comme pour tous les vaccins, ceux à ARNm sont contre-indiqués chez les personnes ayant des antécédents d’allergie sévère à l’un des composants du vaccin ou en cas de réaction anaphylactique après la 1ère dose. Du fait de quelques réactions allergiques graves largement médiatisées, la HAS recommande d’éviter le vaccin chez les personnes présentant des antécédents d’allergie graves de type anaphylactique, dans l’attente de données complémentaires. Les réactions allergiques qui ne relèvent pas de l’anaphylaxie ne constituent pas une contre-indication à la vaccination. La Fédération française d'allergologie a précisé que « les antécédents d’allergie ou d’anaphylaxie ne constituent en aucun cas une contre-indication systématique à cette vaccination ». En pratique, l'administration de ces vaccins (comme pour tout autre vaccin) doit être réalisée dans des conditions permettant de gérer une réaction d’hypersensibilité immédiate grave : adrénaline injectable (stylo auto-injecteur ou flacon + seringue) à disposition et observation des personnes vaccinées pendant au moins 15 minutes pour tous les patients et 30 minutes pour les patients à risque.
Les vaccins à ARNm semblent provoquer des réactions anaphylactiques (ou anaphylactoïdes) plus fréquentes qu’avec les autres vaccins. En connait-on les raisons ? Dans la littérature l’incidence des réactions anaphylactiques au décours d’une vaccination est estimée de 1/500.000 à 1/1.000.000. Aux USA, pour les vaccins Pfizer-BioNTech (Comirnaty®) et Moderna, l’incidence estimée par les CDC est de 1/200.000 à 1/400.000 doses. Comme il n’est pas envisageable que ces réactions immédiates soient dues directement aux ARNm, d’autres composants du vaccin sont suspectés, sans preuve pour l’instant. En effet, dans ces vaccins, l'ARNm très fragile est protégé dans une enveloppe de nanoparticules lipidiques qui lui permettent d’entrer sans être détruit dans les cellules. Ces lipides sont « stabilisés » par des molécules de PEG (polyéthylène glycol) qui recouvrent l'extérieur des nanoparticules. Ces PEG sont déjà présents dans de très nombreux produits cosmétiques et médicaments. Les mécanismes d’anaphylaxie dus au PEG sont peu connus et ne font pas intervenir systématiquement les IgE, mais d’autres immunoglobulines et le complément (c'est pourquoi on parle parfois de réactions "anaphylactoïdes"). Une étude très récente aux USA montre que dans plus de 71% des cas, les réactions anaphylactiques surviennent dans les 15 minutes après l’injection et 86% des cas dans la demi-heure : 80% avaient des antécédents allergiques, un tiers avait déjà fait un choc anaphylactique, Tous ont eu une évolution favorable après traitement adapté (dont il est impératif de disposer).
Les patients ayant déjà présenté une COVID-19 doivent-ils être vaccinés ? Oui, avec une seule dose, à l’exception des personnes sévèrement immunodéprimées. La question essentielle est celle du délai : au minimum 3 mois par exemple pour obtenir un passeport sanitaire, dans l’idéal dans les 6 mois à 1 an suivant la maladie. Plusieurs études récentes réalisées dans différents pays montrent que les patients ayant contracté la maladie seraient protégés à plus de 80-90% au moins sur une période de 6 à 8 mois, voire 1 an. La qualité et la durée de protection dépendent du degré d’homologie existant entre la souche responsable de l’infection initiale et les variants circulants. D’autres études ont montré qu’une dose de vaccin à ARNm chez les patients préalablement infectés donnait des titres d’anticorps très supérieurs à ceux des sujets naïfs, et supérieurs ou égaux à ceux des personnes ayant reçu 2 doses, faisant parler d’immunité hybride ou de super-immunité. Cependant, la majorité des experts, du fait de l’évolution des variants, estiment qu’une dose « Booster» est nécessaire 5 à 6 mois après cette première dose post-maladie.
Je dois vacciner un adolescent de 13 ans par un Gardasil9®. Il a reçu sa première injection Comirnaty® le 16 juin et doit avoir la seconde dose le 3 août. Doit-on respecter un délai entre le vaccin Pfizer et les autres vaccins qu’un adolescent peut éventuellement recevoir ? Non !!! La règle générale en vaccinologie est qu’il n’y a pas lieu de respecter un intervalle particulier entre deux vaccins inactivés ou entre un vaccin inactivé et un vaccin vivant. Un délai de 15 jours entre les doses de vaccins anti-Covid 19 et une autre vaccination a été recommandé (de façon logique) pour pouvoir bien différencier les effets indésirables de chacun (ceux des vaccins contre la COVID-19 n’étant pas connus). Cette précaution a été désormais supprimée aux USA. Lorsqu’il n’y a pas urgence, ce délai peut être respecté sans problème. Toutefois, si nécessaire ou si cela complique trop vos schémas de rattrapage, vous pouvez y renoncer sans crainte.
Y a-t-il des vaccins qui ne peuvent PAS être faits en même temps que le rappel COVID ? Non, aucun.
Le vaccin AstraZeneca (Vaxzevria®) est-il aussi efficace que les vaccins à ARNm ? Oui sur les formes graves et la mortalité et sur les souches ancestrales ou le variant alpha ! Dans plusieurs études versus comparateur, ce vaccin comportant la protéine spike vectorisée sur un adénovirus simien non répliquant a montré une efficacité comprise entre 60 % et 90% ainsi qu’une bonne tolérance. Cette efficacité en apparence moindre que celle des vaccins à ARNm est compensée par des conditions de conservation classique à +2°C - + 8°C permettant son utilisation dans des cabinets médicaux voire dans des pharmacies. De plus, son coût était nettement moindre et il était espéré une plus grande disponibilité …à terme. Depuis, la large utilisation de ce vaccin en Angleterre et des données d’efficacité en vie réelle en Ecosse, ont montré plusieurs éléments très prometteurs :
- Dès la première dose, l’efficacité sur les hospitalisations pour COVID-19 est similaire à celle du vaccin à ARNm et avoisine les 90%,
- L’efficacité d’une dose du vaccin d’AstraZeneca est similaire à celle d’une dose du vaccin à ARNm de Pfizer-BioNtech à partir de J14 post dose 1.
- Un espacement des deux doses de vaccins à 12 semaines au lieu de 4, augmente l’immunogénicité et l’efficacité,
- Mais l’émergence du variant ∂ en Angleterre, pour lequel 2 doses de vaccins sont nécessaires pour augmenter l’efficacité a conduit les autorités de santé de ce pays à rapprocher les doses entre 4 et 6 semaines.
Chez les sujets jeunes, la réactogénicité générale (syndromes pseudo-grippaux) du vaccin, assez forte, invite à prévenir les patients, à accompagner la vaccination d’administration de paracétamol mais ne contre-indique pas la seconde dose.
L’Agence européenne du médicament (EMA) et l’ANSM ont établi un lien entre les accidents thromboemboliques atypiques graves (thrombose veineuse, thrombose splanchnique, CIVD) et l’administration du vaccin AstraZeneca (voir plus loin à Thrombose). L’OMS comme l’EMA ne remettent cependant pas en cause le rapport bénéfice risque de ce vaccin. La France limite son usage aux plus de 55 ans, le Royaume Uni aux > 30 ans, d’autres pays aux > 60 ans ; rares sont ceux qui ont interrompu la vaccination par ce vaccin à ce jour. Nous vous conseillons la lecture du document de l’université de Cambridge qui donne une approche visuelle du rapport bénéfice/risque du vaccin AZ en fonction de l’âge, dans les 4 mois qui suivent l’administration du vaccin. Pour les personnes de < 55 ans ayant reçu une 1ére dose d’AZ, la HAS recommande une 2e dose par vaccin à ARNm, 12 semaines après la 1ere. Bien qu’utilisant des technologies différentes, ces deux types de vaccin conduisent à la production de la protéine S du SARS-CoV-2, contre laquelle est dirigée la réponse immunitaire. Cette technique, qui consiste à administrer un vaccin diffèrent à la 2ème injection de celui utilisé pour la 1ère, porte le nom de « Prime-Boost » hétérologue et est susceptible de donner des résultats d’immunogénicité au moins égaux au «Prime-Boost» homologue. Cela semble être le cas pour la séquence vaccination AstraZeneca puis vaccin à ARNm 2 mois après.
Pour la vaccination COVID, que conseiller à nos patients avec maladies auto-immunes (SEP, Lupus...) avec ou sans immunosuppression, ou qui ont eu un Guillain Barré (SGB)? A ce jour, aucun signal d’induction ni d’exacerbation plus fréquente de maladie auto-immune n’a été identifié après vaccination en dehors de SGB après le vaccin Johnson et Johnson (vaccin peu utilisé en France) avec une incidence de 1 à 2 cas/ million de vaccinés. Ainsi, la vaccination pour ces patients à risque (sous réserve d’une immunosupression permettant d’espérer une protection au moins partielle) est-elle recommandée.
Concernant la vaccination SARS-CoV-2 et les biothérapies (Canakinuma® et Adalimuma®), y a-t-il des consignes particulières, notamment un temps à respecter entre vaccin et traitement ? Comme pour les autres vaccins, le niveau d’immunodépression induit par les anti-TNF et les anti-IL1 diminue l’immunogénicité des vaccins contre la Covid-19. Il est recommandé de vacciner ces patients avec des vaccins à ARNm les plus immunogènes. La vaccination en 3 doses (ou maladie + 2 doses) concerne les immunodéprimés. Pour les biothérapies, seules les anti-CD20 sont mentionnées actuellement pour le schéma renforcé en 3 doses sans intervalle à respecter entre traitement et vaccin. La situation peut toutefois évoluer dès les prochaines semaines du fait de l’émergence du variant ∂.
Pourquoi et comment le booster augmente-t-il la réponse immunitaire ? La vaccination (ou l’infection) entraîne une augmentation du nombre de cellules immunitaires spécifiques à (ou aux) antigène(s) présenté(s). Ces cellules produisent des anticorps et d'autres molécules permettant de lutter contre l’agent pathogène. Ce pool de cellules immunitaires (plasmocytes à longue demi-vie) diminue ensuite lentement. Parallèlement s’installe une immunité mémoire grâce aux lymphocytes B et T "mémoires", qui nécessite un temps minimum (4 à 6 mois) de maturation et de différenciation pour être pleinement efficaces lors d'infections futures par cet agent pathogène. Cette dose de vaccin administrée plusieurs mois après la première immunisation a plusieurs effets sur ces cellules :
- Il provoque la multiplication des cellules B productrices d'anticorps, ce qui augmente le taux d'anticorps contre l'agent pathogène à des taux supérieurs à ceux obtenus au décours de la primovaccination (Figure 1). Avec le temps, leur nombre diminuera à nouveau mais le pool de cellules B « mémoires » sera plus important, ce qui entraînera une réponse plus rapide et plus forte lors des expositions ultérieures. Ceci est maintenant démontré après la troisième dose de Comirnaty® administré 6 mois après le schéma initial : Les taux d’anticorps sont 5 à 6 fois plus haut qu’après la deuxième dose.
- La diminution du taux des anticorps est plus lente qu’après la primo-vaccination. Une première et courte pente aussi forte qu’après la primo-immunisation et observée puis les titres d’anticorps diminuent beaucoup plus lentement (Figure 1).
Figure 1. Cinétique théorique des taux d’anticorps après primo-vaccination et rappel.
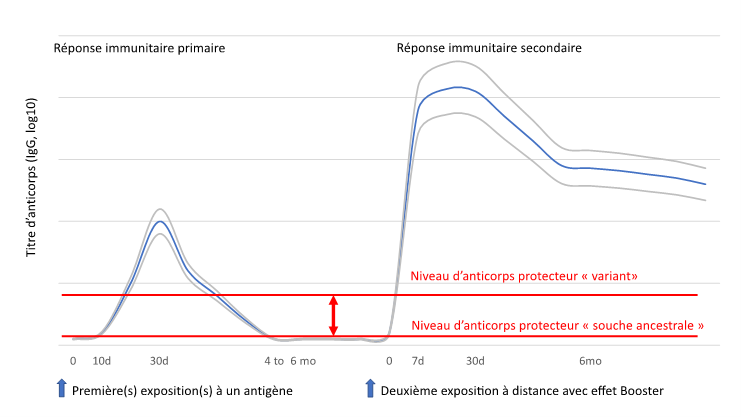
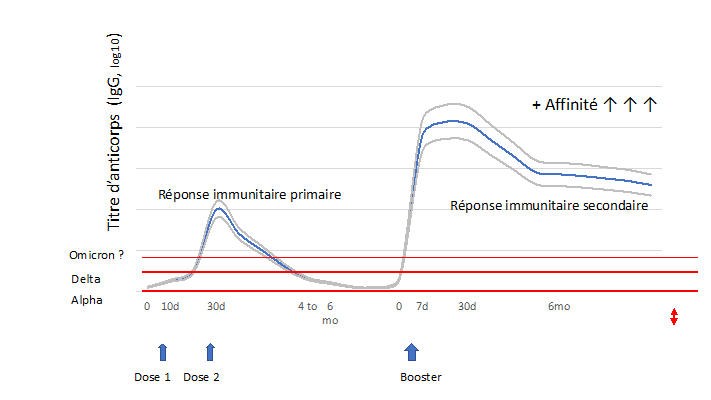
- Il augmente l’affinité des anticorps : les cellules B mémoires migrent vers les ganglions lymphatiques de tout l’organisme où (par leur processus de différenciation et de maturation), elles acquièrent des mutations. Ces mutations produisent entre autres des anticorps qui se lient plus fortement aux agents pathogènes, ce qui peut renforcer leur efficacité.
Pour nombre de vaccins existants, un délai de plusieurs mois (environ 4 à 6 mois) maximise cet effet rappel. Les schémas vaccinaux proposés pour les hexavalents, vaccin anti-pneumococcique conjugué ou contre les papillomavirus suivent ce principe et permettent une immunité de longue durée. Récemment, Pfizer a annoncé qu’une troisième injection du Comirnaty®, administrée 5 à 6 mois après les deux premières doses, suscitait en moyenne des taux d’anticorps trois fois supérieurs à ceux de la deuxième dose, suggérant un effet rappel et laissant entrevoir une bonne efficacité contre le variant ∂. L’efficacité de la dose « booster » réalisée 5 à 6 mois après la primo-vaccination a été évaluée à environ 90% contre le variant ∂ en Israël, tant sur la mortalité que sur les différentes formes de COVID. On peut postuler que la maladie COVID-19, contractée avant ou après une ou deux doses vaccinales, a probablement le même effet de stimulation immunitaire (voire plus) qu’une injection vaccinale. Le nombre de cellules B « mémoires » et les niveaux d'anticorps finissent par se stabiliser après des rappels répétés (ou une réinfection): une injection de rappel suscite des réponses immunitaires plus fortes.
Pourquoi les recommandations d’une dose de « Booster » varient-elles d’un pays à l’autre (âge de recommandation, début du programme) ? Les doses de vaccins étant disponibles, les recommandations dépendent maintenant de la situation épidémiologique, de la date du début du programme de vaccination (les Anglais et les Israéliens ont commencé 3 mois avant nous), de la logistique de la vaccination et des objectifs recherchés :
- si l’objectif est uniquement la prévention des formes graves, il faut proposer un booster aux plus vulnérables, car ce sont eux qui présentent les risques les plus importants. Leur immunité décline plus vite, et ils ont été vaccinés les premiers. L’effet attendu du booster est probablement très prolongé. Les formes graves ne sont pas l’apanage exclusif des plus âgés et une diminution progressive de l’âge (jusqu’à 40 ans ?) pour le booster doit être envisagée. Pour les plus jeunes, une politique acceptable est de les laisser s’immuniser « naturellement » et progressivement par la circulation des variants, étant entendu qu’ils sont très bien protégés contre les formes graves par le schéma de primo-vaccination. C’est le modèle choisi en Angleterre où les mesures de freinage de l’épidémie (distanciation, masques…) ont été stoppées et ou le nombre d’infections a augmenté très rapidement alors que le nombre de décès et des hospitalisations se sont certes accrus mais dans les mêmes proportions. On peut penser que l’attitude qui va être adoptée en France et dans de nombreux pays Européens va y associer un renforcement des mesures de freinages de l’épidémie pour limiter cet hiver la circulation virale et amoindrir le niveau des contaminations.
- si l’objectif est de réduire les infections et la transmission, les sujets plus jeunes doivent être inclus. Il faut noter que cet effet est probablement peu durable, persistant tant que les taux d’anticorps sont suffisamment élevés pour imprégner les muqueuses. Cela peut contribuer à amoindrir un risque épidémique comme en Israël qui a choisi cette option.
-
Une patiente de 76 ans vaccinée en avril-mai a fait un COVID léger fin août. Quand lui recommander un rappel ? Elle a eu 3 expositions mais sans un intervalle suffisant avant son infection pour maximiser l’effet « booster ». L’administration d’un rappel 5 à 6 mois après le COVID parait prudent.
-
Un patient de 55 ans appartenant à un groupe à risque a fait un COVID en mars 2020 et a eu une dose de vaccin en juin 2021. Quand lui recommander un rappel ? Six mois après sa vaccination, maintenant !
Une de mes patientes a présenté, un peu plus d’une semaine après l’administration d’un vaccin à ARNm, une rougeur et une inflammation marquée au niveau du site de l’injection. Peut-on lui administrer la deuxième dose ? Oui, des cas relativement nombreux ont été rapportés des « gros bras » apparaissant une semaine après l’injection d’un vaccin à ARNm. Il s’agit d’une réaction d’immunité cellulaire retardée survenant en moyenne 10 jours après la vaccination, confirmée par des biopsies et disparaissant en moins d’une semaine. Elle serait plus fréquente avec le Spikevax® qu’avec le Comirnaty® et plus difficile à diagnostiquer chez les patients dans les populations afro-américaines et amérindiennes. Ces patients ont été revaccinés sans aucune réaction lors de la deuxième dose ou une réaction pas plus importante. Ce n’est donc pas une contre-indication à la deuxième dose.
De nombreux patients âgés ou ayant des facteurs de risque pour les formes graves de la COVID-19, premiers candidats à la vaccination, sont sous anticoagulants. Doit-on les vacciner contre le SARS-CoV-2 comme cela est indiqué, par voie intramusculaire (IM) ou par voie sous cutanée (SC) ? Classiquement, on ne fait pas d’IM aux patients sous anticoagulants ou présentant des troubles de l’hémostase du fait du risque d’hématome et d’hémorragie. Cela ne doit pas s’appliquer aux vaccins. En effet, les volumes à injecter sont faibles (0,5 ml généralement, 0,3 ml pour le vaccin PFIZER-BioNTech) et plusieurs études ont montré que la vaccination IM dans le deltoïde associée à une compression prolongée, est bien tolérée chez les patients sous anticoagulants. Par contre, la voie sous cutanée expose à une moins bonne immunogénicité (en particulier chez les sujets âgés) et à une augmentation de la réactogénicité locale. (Evans DI BMJ. 1990 ;300:1694-5. Raj G Arch Intern Med. 1995;155:1529-31. Delafuente JC Pharmacotherapy. 1998;18:631-6.Casajuana J BMC Blood Disord. 2008;8:…biblio non exhaustive). Enfin, les études cliniques d’immunogénicité et d’efficacité ayant conduit aux AMM ont été réalisées par voie IM. Donc en pratique : ne pas renoncer à une vaccination IM en raison d’une anticoagulation, les vaccins inactivés peuvent et doivent être administrés par voie IM, seuls les vaccins viraux vivants (ROR, Fièvre Jaune, Varicelle, Zostavax®) peuvent continuer à être injectés par voie SC.
Pour les vaccins COVID-19, bien qu’il n’existe aucune donnée pour ce type de patients, les réactions locales relativement marquées (pouvant inquiéter certains…) risquent d’être fortement augmentées, la voie IM paraît donc particulièrement adaptée. Les précautions sont simples :
- toujours vacciner dans le deltoïde (c’est plus facile à surveiller et à comprimer)
- utiliser une aiguille longue et fine (les aiguilles oranges et d’une longueur de 40 mm sont parfaites)
- comprimer plusieurs minutes (>2’) sans masser ni frotter
- surveiller la zone au décours.
Un sujet contact peut-il recevoir la dose « booster » ? OUI !! et sans délai. Au début il était recommandé de retarder l’injection parce qu’en primo-vaccination, la protection optimale n’apparaissait qu’une dizaine de jours après la deuxième dose et que l’on ne connaissait pas la tolérance. Avec la dose « booster », la montée d’anticorps est beaucoup plus rapide, la durée d’apparition de la protection beaucoup plus courte et aucun signe de mauvaise tolérance n’a été observé. Enfin, vu la transmissibilité du variant Omicron, les cas contacts se multiplient retardant inutilement les programmes vaccinaux.
Combien de temps, les patients vaccinés sont-ils protégés avec les variants ?
Des données en apparence contradictoires sont publiées sur la durée de protection conférées par les vaccins. En fait la réponse est complexe et doit faire prendre en compte plusieurs paramètres :
- Les formes cliniques (décès, séjours en réanimation ou soins intensifs, hospitalisations, formes ambulatoires, formes pauci-symptomatique voire asymptomatiques…)
- Les spécificités du patient (sujet âgé, pathologies sous-jacentes)
- Les variants: les moins sensibles aux vaccins comme Omicron nécessitent des concentrations d’anticorps plus élevées.
La conclusion de ces études est que la durée de protection est plus courte chez les sujets fragiles et/ou âgés, pour les variants moins sensibles aux vaccins et pour les formes les moins graves. Ceci n’est pas étonnant quand on sait que quels que soient les anticorps recherchés, les taux d’anticorps déclinent progressivement après la primo-vaccination notamment chez les sujets les plus âgés et/ou fragiles. Une autre donnée de cette étude est importante à souligner : la très grande dispersion interindividuelle des taux d’anticorps, expliquant en grande partie les échecs chez certains patients.
Ceci amène, dans ce contexte actuel de vague due aux variants Omicron, à proposer, en France, une troisième dose ou plutôt un booster à tous les adultes et les adolescents à risque. L’immunité contre le SARS-CoV-2 étant plus érodée par le temps qu’effondrée, notamment contre les formes graves, des voix (dont celle de l’OMS) s’élèvent contre ces « troisièmes doses » pour concentrer les efforts sur les non vaccinés en France et dans le monde.
Quelles sont les contre-indications médicales à la vaccination contre la COVID-19 ? Elles sont actualisées régulièrement : dans un « DGS Urgent » du 3 Novembre 2021.
Les cas de contre-indications définitives sont :
1° Les contre-indications inscrites dans le résumé des caractéristiques du produit (RCP) :
- antécédent d'allergie documentée (avis allergologue) à un des composants du vaccin en particulier polyéthylène-glycols et par risque d'allergie croisée aux polysorbates ;
- réaction anaphylaxique au moins de grade 2 (atteinte au moins de 2 organes) à une première injection d'un vaccin contre la COVID-19 posée après expertise allergologique ;
- personnes ayant déjà présenté des épisodes de syndrome de fuite capillaire (contre-indication commune au vaccin Vaxzevria® et au vaccin Janssen) ;
- personnes ayant présenté un syndrome thrombotique et thrombocytopénique (STT) suite à la vaccination par Vaxzevria®.
2° Une recommandation médicale de ne pas initier une vaccination (première dose) :
- syndrome inflammatoire multi systémique pédiatrique (PIMS) post- infection par SARS-CoV-2 ;
- myocardites ou myo-péricardites associées à une infection par SARS –CoV-2.
3° Une recommandation établie après concertation médicale pluridisciplinaire de ne pas effectuer la seconde dose de vaccin suite à la survenue d'un effet indésirable d'intensité sévère ou grave attribué à la première dose de vaccin signalé au système de pharmacovigilance (par exemple : la survenue de myocardite, de syndrome de Guillain-Barré …).
4° Une recommandation établie par un Centre de Référence Maladies Rares (CRMR) ou un Centre de Compétence Maladies Rares (CCMR) après concertation médicale pluridisciplinaire (avis collégial) de ne pas initier la vaccination contre la covid-19.
Les cas de contre-indication temporaire sont :
1° Traitement par anticorps monoclonaux anti-SARS-CoV-2 ;
2° Myocardites ou péricardites d’étiologie non liée à une infection par SARS-CoV-2 survenues antérieurement à la vaccination et toujours évolutives.
Le CERFA « Certificat médical de contre-indication à la vaccination COVID-19 n°16183*01 » à destination des médecins est modifié sur le site AmeliPro afin de prendre en compte ces différentes modifications.
Un adolescent de 13 ans a présenté une myocardite sans autres signes de PIMS dans le mois qui a suivi un COVID familial. Est-ce une contre-indication à la vaccination ? Oui !!! Bien que dans les contre-indications officielles cette situation ne figure pas plusieurs arguments plaident pour cette décision. La première est que les myocardites et péricardites aigues (MPA) post COVID sont maintenant parfaitement décrites : elles sont 4 a 6 fois plus fréquentes qu’après vaccination. La seconde est que : les PIMS post COVID, les MPA post vaccination, les MPA évolutives en dehors même de tout contexte COVID sont déjà des contre-indications à la vaccination.
Les vaccins chinois inactivés sont-ils efficaces contre la COVID-19 ? Oui sans aucun doute !
Une étude d’efficacité en vie réelle a été réalisée au Chili avec le Coronovac. Elle montre une efficacité de 65.9% (IC 95% = 65.2- 66.6) pour la prévention de la maladie Covid-19 et d’environ 90 % pour les hospitalisations, séjours en réanimation et décès. Des résultats semblant inférieurs aux vaccins à ARNm disponibles ou au Spoutnik V, mais comparables à ceux des vaccins AstraZeneca ou Janssen. Leur activité sur les variants ß et ∂ n’est pas encore connue avec précision mais très probablement moins bonne que les vaccins à ARNm. Pour le variant Omicron une étude provenant de Hong-kong suggèrent que ces vaccins n’ont aucune efficacité.
Y-a-t-il des corrélations entre les taux d’anticorps anti-spike et la protection clinique ? Oui !!! Dans les études cliniques, les vaccins qui donnaient les titres d’anticorps les plus élevés par rapport à la maladie naturelle sont ceux qui se sont avérés les plus efficaces sur la prévention des COVID-19 symptomatiques. Même dans cette synthèse, les auteurs regrettent la non-standardisation des sérologies d’une étude à l’autre. Ces corrélations ne sont malheureusement pas encore extrapolables à la pratique clinique quotidienne. Néanmoins, le rendu des laboratoires en BAU (Binding Antibody Units définis par l’OMS) va faciliter les choses. Cependant, pour un suivi des taux d’anticorps chez un patient donné, il vaut mieux utiliser la même technique et dans le même laboratoire. D’autres arguments plaident aussi pour des corrélations entre taux d’anticorps (ELISA et neutralisation) et protection.
- Meilleure efficacité sur les formes non graves des vaccins à ARNm comparativement au vaccin Astra-Zeneca sur les variants moins sensibles aux vaccins comme le ∂.
- Meilleure efficacité du Spikevax® (plus immunogène) par rapport au Comirnaty® sur les formes moins sévères dues au ∂.
Quelle couverture vaccinale faut-il atteindre pour nous permettre de vivre à nouveau « normalement » ? Les épidémiologistes ont développé des modèles mathématiques pour étudier l’impact de la vaccination anti-Covid-19 sur l’épidémie. En tenant compte du fait que le variant "britannique" est 60 % plus transmissible que le virus historique et que les vaccins sont efficaces à 80 % contre l'infection (y compris asymptomatique), pour que le nombre d’hospitalisations Covid-19 ne dépasse pas 1000 admissions journalières et pour qu’un relâchement complet des mesures barrières soit envisageable à l'automne 2021, il faudra que plus de 90 % des adultes soient vaccinés. Si la couverture vaccinale chez les adultes est insuffisante, la poursuite de la circulation virale attendue chez les enfants contribuera à l’infection des adultes non protégés et à la prolongation de l’épidémie généralisée. En envisageant la vaccination des adolescents puis des enfants, la vaccination de 60-69 % des moins de 65 ans et de 90 % des 65 ans et plus pourrait permettre de revenir à une vie normale, sans mesures barrières. L’émergence du variant ∂ (plus contagieux R0=6) augmente encore les proportions dans chaque tranche d’âge.
Les réseaux sociaux se font le relais d’informations affirmant que la vaccination serait déjà responsable de milliers de morts. Que faut-il en penser ? Bien entendu, il s’agit d’interprétations malveillantes. Non, il n’y a pas eu un millier de personnes décédées à cause de la vaccination, mais un millier de personnes décédées dans les suites de la vaccination sur les milliards de vaccinés ! La vaccination ne rend pas immortel en quelque sorte…
Des patients âgés ou ayant des facteurs de risque sont susceptibles de recevoir d’autres vaccins (Grippe, Zostavax®, Prevenar13® et ou Pneumovax®). Quel délai doit-on respecter entre les vaccins COVID-19 et les autres vaccins ? Aucun!!! En principe, tous les vaccins non-vivants peuvent être réalisés le même jour ou avec n’importe quel intervalle de temps. En l’absence de données spécifiques et pour faciliter la surveillance en pharmacovigilance des vaccins COVID-19, il avait été recommandé : 1) De ne pas administrer d’autre vaccin entre les deux doses. 2) De respecter un délai d’au moins 2 semaines après la seconde dose. La connaissance des effets secondaires des vaccins COVID-19 ayant beaucoup progressé, le CDC est revenu il y a quelques semaines, sur cette règle. En pratique, il est rare qu’il soit urgent d’administrer les vaccins cités plus haut et ils peuvent donc être décalés. Par exemple, entre le Prevenar13® et le Pneumovax®, le délai minimal de 2 mois peut être prolongé de plusieurs semaines, voire mois. En cas de nécessité de vaccination urgente imposée par une contamination récente (rage, tétanos, hépatites…) ou un voyage, il n’y a pas de contre-indication réelle.
La vaccination COVID peut-elle être effectuée chez un patient en cours de désensibilisation allergique ? Et chez un patient sous anticoagulant ! Oui et oui. Le système immunitaire peut très bien gérer les deux stimulations antigéniques en parallèle et une compression de quelques minutes au site d’injection intramusculaire suffit pour les patients anti-coagulés, comme pour les autres vaccins.
La pandémie actuelle a imposé des mesures d’hygiènes (distancement, masques, lavages des mains, réductions du nombre de contacts…) qui ont permis de limiter la transmission du SARS-CoV2. Elles ont aussi freiné la propagation d’autres pathogènes. Ainsi le nombre de consultations pour pathologie infectieuse pédiatrique a diminué drastiquement, non seulement pendant les phases de confinement mais aussi après malgré une reprise scolaire quasi normale. Les pathologies concernées sont nombreuses. Il s’agit de pathologies courantes comme les gastro-entérites notamment à Rotavirus, les bronchiolites à VRS, les varicelles, les otites, les infections à entérovirus…mais aussi de pathologies plus graves comme les infections invasives à pneumocoques ou à méningocoques. Ceci n’est pas étonnant car les modes de transmission sont les mêmes (grosses gouttelettes et mains) avec pour certaines d’entre elles comme la grippe des R0 inférieurs au SARS-CoV-2. Cet effet collatéral positif à court terme est très appréciable car il a évité les habituels pics épidémiques avec sa surcharge accrue des recours aux urgences hospitalières pendant la pandémie Covid. Cependant ces infections, le plus souvent virales de la petite enfance, sont quasiment obligatoires dans les premières années de vie et cette privation immunitaire relative pourrait avoir à distance des conséquences négatives sur le développement immunitaire des enfants avec d’une part une diminution de l’entrainement de l’immunité innée conduisant à une « dette immunitaire » constituée (risque d’épidémies plus importantes) et d’autre part un retour en grâce de la théorie hygiéniste. Des preuves du concept de dette immunitaire s’accumulent pour le VRS, les entérovirus et l’intensité du début des épidémies automno-hivernales en France dès le mois de septembre. Certains de ces virus (rotavirus, varicelle) ou bactéries (méningocoques B et ACYW) pourraient bénéficier de la protection de vaccins non encore inclus dans le calendrier vaccinal ou qui avait été suspendus (rotavirus). La France qui a un des calendriers vaccinaux les moins étoffés d’Europe, est probablement moins bien armée pour répondre à ces rebonds épidémiques. Dans les pays en voie de développement, du fait de la baisse des couvertures vaccinales et de la surcharge des systèmes de santé, l’incidence et le poids des maladies comme la tuberculose, la rougeole ou la poliomyélite risquent d’augmenter. Même en France, le retard vaccinal créé par le premier confinement n’a pas été résorbé en 2020, et une dette de vaccination existe, notamment pour la rougeole et la coqueluche.
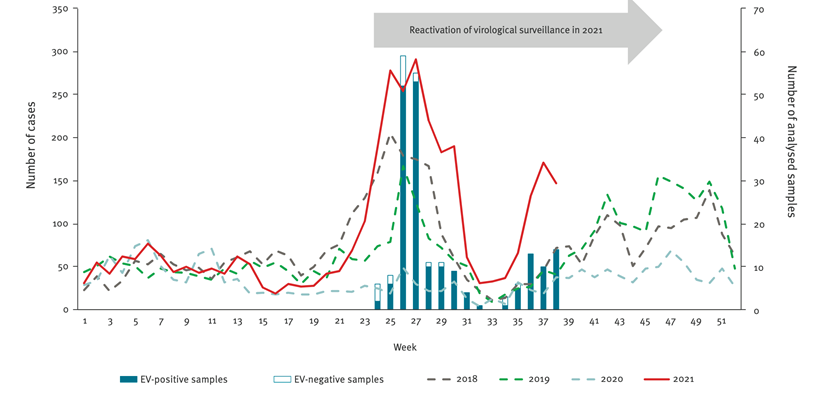
Le concept de dette immunitaire induite par les mesures d’hygiène imposées par la pandémie COVID a-t-il était confirmé pour des infections pédiatriques ? Oui !!! Le concept de dette immunitaire que nous avions été les premiers à envisager il y a plus d’un an, a été démontré pour plusieurs virus notamment VRS et entérovirus.
Pour les entérovirus , une étude conjointe du Centre National de Référence des entérovirus et des pédiatres de PARI ont retrouvé en 2021, une augmentation très significative du nombre de cas par rapport à la situation pré-pandémique, sans qu’un sérotype domine.
Pour le VRS et les bronchiolites, une étude néo-zélandaise le confirme aussi avec un pic et un nombre de cas jamais atteint avant la pandémie.
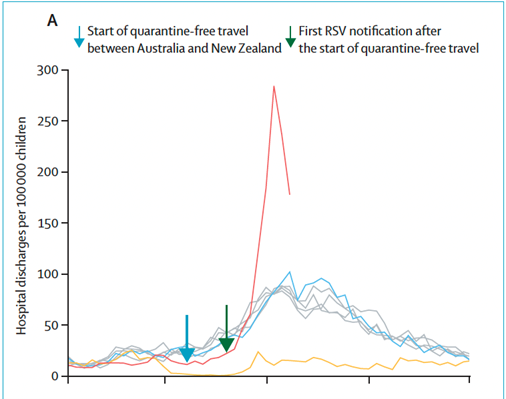
Peut-il-y avoir également une dette immunitaire pour les infections bactériennes ? Oui ! Aussi pour le méningocoque B. Une étude venant d’outre-Manche le confirme. Les auteurs notent qu’entre septembre et novembre 2021, le nombre de cas de d’IIM du groupe B a augmenté chez les adolescents/jeunes adultes, et dépassé les niveaux pré-pandémiques. Il n’y a pas eu d’augmentation des autres sérogroupes car les enfants et adolescents anglais sont très largement vaccinés par les vaccins contre les méningocoques ACYW, suggérant que les programmes de vaccination maintiennent de faibles taux de portage et de maladie contre ces sérogroupes. En revanche, la faible immunité contre les souches du groupe B s’explique :
- d’une part, par la faible transmission des méningocoques pendant les phases de confinement et mesures d’hygiène strictes, limitant l’immunisation naturelle
- d’autre part, par le fait que les adolescents ne sont pas vaccinés contre le méningocoque B (seuls les nourrissons le sont) et que cette vaccination n’influence pas le portage.
- maintenant, la forte transmission des méningocoques chez les adolescents/jeunes adultes a entraîné le retour de la maladie du groupe B, en particulier chez les étudiants.
Existe-t-il des différences d’efficacité et de tolérance entre les deux vaccins à ARNm ? Oui !!! Ces deux vaccins « jumeaux » en termes de conception (vaccin à ARNm, nanoparticules lipidiques, PEG…), présentaient tous deux après 2 doses, environ 95% d’efficacité sur les formes cliniques de COVID-19 (dues aux souches ancestrales et au variant alpha) et avaient schématiquement le même profil de tolérance. Cependant, les différences de dosages entre les vaccins de Moderna (3 fois plus dosés en ARNm) et de Pfizer ont des conséquences non seulement en termes d’immunogénicité et d’efficacité sur le ∂ (le 1er étant plus immunogène et probablement plus efficace sur le ∂) mais aussi en termes de tolérance. Une étude confirme que le Spikevax® provoquerait plus de myocardites et péricardites chez les sujets jeunes. De ce fait, la HAS ne recommande plus le Spikevax® chez les moins de 30 ans. On espère que les futures recommandations privilégieront logiquement : le Spikevax® aux sujets dont l’immunogénicité est la moins bonne ou la moins durable, le Comirnaty® pour les autres.
Je dois vacciner bientôt un jeune adolescent de 11 ans et 11 mois. Dois-je lui faire la dose « enfant » (10 mcg) ou la dose « adulte » (30 mcg) ? Si vous suivez l’AMM et les connaissances sur l’immunogénicité des vaccins c’est la dose enfant qu’il faut utiliser. En effet, une étude faite avec la dose pédiatrique montre que chez les enfants de 5 à 11 ans, les taux d’anticorps obtenus sont identiques à ceux retrouvés avec la dose de 30 mg chez l’adulte jeune. C’est ce qui a conduit au choix de cette dose dans l’étude pivot et pour l’AMM. Pour les 12 à 15 ans, c’est la dose « adulte » qui a été utilisée (nous ne connaissons pas d’étude publiée de « dose-ranging » chez l’adolescent) mais on sait qu’elle induit des taux d’anticorps significativement plus élevés que chez l’adulte jeune (ratio des moyennes géométriques du taux d’anticorps à 1,7). La plus forte réponse immunitaire observée chez les adolescents a été observée pour de nombreux vaccins (hépatite B, papillomavirus…). Une plus grande quantité d’anticorps peut entrainer une plus grande efficacité mais aussi une plus forte réactogénicité. Même pour la 2ème dose, si l’adolescent vient de dépasser 12 ans, il parait cohérent, même si cela ne correspond pas à l’AMM, de leur proposer la dose enfant.
Un patient qui a eu la COVID-19 en mars 2021 et qui relève donc d’un schéma en une dose unique, a reçu une dose incomplète de vaccin à ARNm (perte de 1/3 à 1/2 de la dose). Devons-nous lui réinjecter une seconde dose ? Dans quel délai ? En général, en vaccinologie, il est conseillé de ne pas tenir compte des doses incomplètes et de refaire la vaccination en cas de perte de produit, mais dans le cadre de la vaccination anti-COVID 19, cette règle ne peut être appliquée aussi simplement. Il faudrait tenir compte : du vaccin (les vaccins à ARNm sont bien plus immunogènes), de l'âge (les sujets jeunes ont des taux d’anticorps bien plus élevés) et du sexe en raison de complications potentielles (péricardites-myocardites aiguës) chez les patients < 30 ans et essentiellement chez les hommes. Une étude très montre qu’un quart de dose de vaccin Moderna (le plus dosé des vaccins à ARNm) donne une excellente réponse immunitaire. Pour les rappels, les anglais ne font qu’une demi doses de Spikevax®.
Combien de temps, les patients ayant été infectés par le SARS-CoV-2, sont-ils protégés ? Plus d’un an en moyenne, mais cela dépend des différences entre la souche infectante et les variants circulants. Avant le variant ∂, une étude italienne publiée dans le JAMA avait montré qu’un antécédent d’infection par le SARS-CoV-2 (avec ou sans symptômes) protégeait d’une réinfection au moins durant 1 an. Parmi 1579 personnes ayant un tel antécédent, 5 (0,3 %) se sont réinfectées (une seule hospitalisation, aucun décès). La protection de l’infection naturelle était estimée à 99,7 %. De plus, une étude strasbourgeoise confirme que la grande majorité des patients conservait ses taux d’anticorps à des taux considérés comme protecteurs plus d’un an après la maladie. Ce bon résultat en population générale doit être largement pondéré pour les immunodéprimés, voire les sujets les plus âgés et surtout l’en fonction de l’émergence des variants : certains d’entre eux (Sud-Africain > Brésilien> Indien) nécessitent des taux d’anticorps plus élevés et réduisent la durée de protection. Des données in vitro avaient suggéré que la réponse anticorps après vaccination neutralisait mieux certains variants que celle induite après l’infection « naturelle ». Des données en vie réelle avant l’émergence du ∂, le confirment : une étude cas contrôle ayant eu lieu en mai-juin 2021 au Kentucky (ayant inclus 246 cas et 492 contrôles) retrouvait une probabilité de réinfection 2.34 fois plus importante chez les non vaccinés ayant fait une infection naturelle. Ce n’est peut-être pas le cas pour le ∂. Une large étude israélienne suggère qu’avec le variant ∂, 6 mois ou plus après la maladie ou la vaccination, l’effet protecteur est significativement plus important contre l’infection à SARS CoV-2 en cas d’immunité post maladie (OR = 13 IC 95% 8.08 à 21). Les mieux protégés sont ceux qui ont reçu une dose de vaccin après avoir eu la COVID-19. Ceci n’est pas incohérent : les vaccins ne suscitent qu’une immunité anti-spike (certes à des taux plus élevés qu’après la maladie naturelle) alors que l’infection induit aussi la production d’anticorps contre d’autres antigènes du virus (notamment anti-nucléocapsides) qui pourrait jouer un rôle protecteur.
Quelle est l’efficacité des vaccins à ARNm à 6 mois ? Les résultats des essais cliniques du Comirnaty® et du Spikevax® concernant la sécurité et l’efficacité 6 mois après la 2nde dose ont été publiés. L’efficacité vaccinale a été calculée sur la base des cas de Covid-19 survenus entre J7 post-2nde dose, n’ayant pas d’antécédent de SARS-CoV-2. Pour le Comirnaty®, l’efficacité était excellente sur les cas de Covid-19 symptomatiques 91,3 % (IC95% 89-93). Cependant, celle-ci diminuait avec le temps : 96,2 % entre J7 post-2nde dose et M2, 90,1 % entre M2 et M4 et 83,7 % (IC95% 74,7-89,9) entre M4 et M6-7. Un antécédent d’infection par le SARS-CoV-2 conférait une protection de 72,6 % et 1 dose de vaccin après infection réduisait encore le risque de Covid-19 symptomatique. Pour le Spikevax® l’efficacité était excellente sur les cas de Covid-19 symptomatiques 93,2% (IC95% 91-95). L’efficacité dans la prévention des formes graves était de 98,2% (IC95% 92.8-99,4) et de 63% ((IC95% 56.6-68,5). Ces résultats avaient été observés avant l’émergence des ∂ et omicron.
Que faudra-t-il proposer aux patients qui, malgré une première dose de vaccin, ont fait une COVID-19 ? Il n’y a pas de réponse fondée sur des preuves. Après une dose de vaccin dans les études initiales avec les souches qui prédominaient au début de l’épidémie, si dans les 10 premiers jours aucune protection significative n’est observée, après ce délai, le taux de protection était estimé à 80% pour les vaccins à ARNm (avec des intervalles de confiance étroit). L’attitude la plus raisonnable pour eux est de les considérer comme des patients ayant fait la COVID-19 et de leur proposer une dose complémentaire de vaccin 5 à 6 mois après la maladie.
Le fait d’être vacciné diminue-t-il le risque de transmission en cas d’échec vaccinal ? OUI !!! Avant l’émergence d’omicron, plusieurs études avaient montré qu'être vacciné réduisait le risque d'être infecté mais ne l’éliminait pas. Peu d’études avaient évalué l’impact direct de la vaccination sur le risque de transmission si la personne vaccinée développait la Covid-19. Une étude anglaise avait évalué ce risque en comparant plus de 57 000 contacts de 24 000 ménages dans lesquels un cas confirmé en laboratoire avait été identifié chez une personne vaccinée, avec près d'un million de contacts de cas positifs chez des personnes non vaccinées. Les individus infectés 3 semaines après avoir reçu une dose d’un vaccin Pfizer-BioNTech ou AstraZeneca étaient entre 38 % et 49 % moins susceptibles de transmettre le virus à leurs contacts vivant sous le même toit que ceux qui n'étaient pas vaccinés. La protection a été observée à partir de 14 jours après la vaccination, avec des niveaux de protection similaires quel que soit l'âge des cas ou celui des contacts. Le domicile est un lieu à haut risque de transmission ; cette étude fournit des preuves de l'impact des vaccins sur la prévention de la transmission. Des résultats similaires peuvent être attendus dans d'autres contextes présentant des risques de transmission similaires, tels que les logements partagés, les EPHAD ou les prisons. Même pour le variant ∂ pour lequel les vaccins sont un peu moins efficaces, des données similaires existent.
Les patients qui ont été vaccinés et qui ont présenté un échec de vaccination ont-ils le même profil de présentation clinique ? Non !!! On connaissait la grande efficacité des vaccins contre le SARS-CoV-2 en particulier des vaccins à ARNm pour prévenir la maladie COVID et la transmission. Cependant cette efficacité n’était pas à 100 % et des échecs sont rapportés. Une étude du CDC a étudié le profil clinique de ces échecs comparé aux cas survenus sans vaccination. La charge virale était inférieure en moyenne de 40%, le risque de fièvre inférieure à 59%, et la durée de la maladie inférieure de 2,3 jours. Toutes ces différences étaient significatives.
Quel est le profil des patients qui ont présenté une forme grave de COVID malgré 2 doses de vaccin ? Une étude Israélienne avait décrit une cohorte de 156 patients. Il s’agit essentiellement d’hommes âgés (> 70 ans) avec des comorbidités (96 %). Sur les six patients sans comorbidité, seuls trois présentaient une COVID-19 sévère, tous avec une issue favorable. Ces comorbidités étaient plus fréquentes que chez les sujets non vaccinés : diabète (48% contre 27,9%-34. 7%), hypertension (71% contre 43,5%-62%), insuffisance cardiaque (28% contre 5,8%-12,8%), maladies pulmonaires chroniques (24% contre 7,4%-16,5%), maladies rénales chroniques (32% contre 12,7%-22,8%) et cancer (24% contre 4,8%-10,8%).
Quel était le degré de protection conféré par une seule dose de vaccin ? Il faut distinguer les vaccins à ARNm des vaccins vectorisés avec un adénovirus et le variant viral. Dans les deux études de phase 3 des vaccins à ARNm et avec les souches « historiques » du SARS-CoV-2, une protection supérieure à 50 % a été observée dans le mois suivant la première dose, mais il faut noter qu’à partir de 10 jours après la première dose (temps nécessaire à la mise en place de la réponse immunitaire primaire), le taux de protection vis-à-vis du COVID-19 était de 86,7 % (IC95% = 68,6%-95,4%). Le délai moyen entre la contamination et les signes cliniques étant en moyenne de 5 jours, on peut penser que la majorité des vaccinés sont protégés d’une contamination dès le 7ème jour après la vaccination vis-à-vis de la souche Wuhan. Ces résultats ont été confirmés dans des études d’efficacité en vie réelle, en Israël, Angleterre et Ecosse. Cependant des incertitudes persistaient quant à la durée de protection, les taux d’anticorps étant sensiblement moins élevés après une dose qu’après 2 doses. La vaccination complète avec 2 doses assure une protection de l’ordre de 95 % (Liens 1 et 2). Ce qui a été confirmé aussi dans les études en vie réelle. Pour les vaccins vectorisés sur un adénovirus, les données d’efficacité montraient une protection assez prolongée : ainsi le vaccin Johnson&Johnson peut être administré en une dose (avec une efficacité sur plusieurs mois de 66%) et l’efficacité d’une dose d’AstraZeneca à 3 mois semblait se maintenir. La situation est différente avec l’émergence des variants (ß, ∂ et omicron) qui nécessitent des taux d’anticorps plus élevés et pour lesquels une dose est clairement moins efficace. En conclusion : administrer les 2 doses dans les délais recommandés et proposer un « booster » quelques mois après.
Quel niveau d’effectiveness (efficacité en vie réelle) peut-on espérer sur le variant ∂ avec les vaccins à ARNm ? Le niveau d’efficacité observé dépend de l’objectif mesuré :
- excellent sur les formes graves (globalement > 90 à 95%) : les échecs pour les hospitalisations et/ou les formes graves survenant essentiellement chez des sujets âgés et/ou avec comorbidités,
- un peu moins bon pour les formes cliniques moins sévères : entre 50 et 88 % en fonction des études et surtout du délai depuis la vaccination, l’efficacité s’érodant dans le temps,
- moins efficace pour réduire la transmission : plusieurs études retrouvent que, chez les patients ayant présenté la COVID-19 malgré 2 doses de vaccins, la charge virale (indexée par un nombre de CT) était très élevée, comparable à celle des non vaccinés. Ceci suggère au moins lorsqu’ils sont symptomatiques, que les patients vaccinés sont aussi contagieux. Cependant, une large étude anglaise sur des patients asymptomatiques et symptomatiques retrouve un nombre de CT significativement plus faible chez les vaccinés infectés. Enfin, une étude montre une baisse plus rapide de la charge virale chez les vaccinés.
Pourquoi les enfants n’ont-ils pas été inclus initialement dans les études et dans les recommandations vaccinales contre le SARS-CoV-2 ?
Pour de deux raisons :
1) Ils présentent beaucoup moins souvent de symptômes que les adultes et encore moins souvent de formes graves ;
2) Ils sont moins contaminés et moins contaminants ; à l’évidence, ils jouent un rôle limité dans la dynamique de la pandémie. Cependant des syndromes inflammatoires multi-systémiques pédiatriques (MIS-C ou PIMS) proches de la maladie de Kawasaki et la possibilité de COVID longs, dont la fréquence (probablement rare) et le type sont inconnus à ce jour, ont été rapportés. Cependant, l’émergence du variant ∂ d’une part, la preuve de l’effet sur la transmission donc sur l’immunité de groupe étant maintenant apportée et les données de sécurité étant mieux établies chez l’adulte et l’adolescent d’autre part, ils pourront faire partie des cibles de la vaccination si les données sur la sécurité des vaccins dans cette population sont favorables, ce qui semble être le cas sur les premières données de pharmacovigilance américaine. Il n’en reste pas moins que la vaccination peut être proposée rapidement aux enfants à risque de formes graves. Dans le monde, déjà des milliers d’enfants porteurs de facteurs de risque, ont reçu à ce jour, le vaccin de Pfizer-BioNTech sans effet indésirable notable. Il est important de noter que l’émergence des variants très contagieux et que le fait qu’une proportion importante d’adultes et d’adolescents soit maintenant vaccinée sans que les enfants le soient, risquent dans les pays ayant accès au vaccin de transformer la COVID-19 en une maladie pédiatrique.
Dispose-t-on de données d’immunogénicité, d’efficacité et de tolérance chez les enfants ? Oui !
L’étude du Comirnaty® chez les enfants de 5 à 11 ans a été publiée : double aveugle (randomisée 2/1 versus placebo) comportant environ 2250 enfants, avec un dosage à 10 microgrammes, 3 fois plus faible que celui utilisé chez l’adulte et l’adolescent. Malgré cette dose réduite, l’immunogénicité, l’efficacité et la tolérance sont comparables à celles observées chez l’adulte. L’immunogénicité chez 264 enfants a été comparée à celle de 253 adultes âgés de 16 à 25 ans. La moyenne géométrique du taux d’anticorps était de 1197 (IC95% 1106-1296) chez les enfants et 1148 (IC95% 1045-1257) chez les adultes : ratio moyen 1,04 (IC95% = 0,93-1,18). L’efficacité sur les formes symptomatiques a été évaluée à 90,7% (IC95%=67,7-98,3%) avec 3 cas dans le groupe vacciné (1305 enfants) et 16 dans le groupe placebo (663 enfants). Les effets indésirables (douleurs au point d’injection, rougeur, fièvre, asthénie…), étaient équivalents entre la 1ère et la 2ème dose et comparable à ce qui était connu chez l’adulte. En France, les sociétés savantes de pédiatrie et la Société de Pathologie Infectieuse de Langue Française ont considéré que la vaccination des 5-11 ans n’apparaissait pas pour l’instant comme une urgence car la situation aux États-Unis (où elle a été recommandée depuis le 1 er novembre 2021) était différente de celle de la France.
Le tableau suivant compare les données Françaises et Américaines début décembre 2021, avant Omicron.
|
Données Américaines et Françaises |
France |
États-Unis |
Facteur de multiplication |
||
|
|
N de cas |
Incidence |
N de cas |
Incidence |
|
|
Population globale (millions) |
≈ 67 |
|
≈ 335 |
|
|
|
Population des 5-11 ans (millions) |
5 |
|
28 |
|
|
|
Nombre d’hospitalisations pour les 5-11 ans |
1284 |
1,91 |
8.300 |
2,48 |
1,3 |
|
Nombre de PIMS chez les 5-11 ans |
351 |
0,52 |
3.100 |
0,93 |
1,8 |
|
Nombre de séjours en réanimation chez les 5-11 ans |
226 |
0,34 |
2.700 |
0,81 |
2,4 |
|
Nombre de décès chez les 5-11 ans |
3 |
0,004 |
94 |
0,03 |
7,5 |
|
Séroprévalence chez les 5-11 ans |
16% |
|
40% |
16% |
2,5 |
|
Nombre de semaines de fermeture d’école |
10 |
|
47 |
|
4,7 |
|
Pourcentage d’adultes vaccinés |
≈ 90% |
|
≈ 70% |
|
|
|
Pourcentage d’adolescents vaccinés |
≈ 80% |
|
≈ 50% |
|
|
En deux mois, sur environ 25 millions de petits américains dans cette tranche d’âge, 7 millions ont déjà reçu une dose et plus de 2 millions deux doses.
La vaccination des enfants de 5 à 11 ans peut-elle avoir un impact sur l’épidémie de variant ∂ ou Omicron ? Vu l’émergence du variant Omicron aucune projection sérieuse ne peut être faite. En effet, après une, voire deux doses, la protection contre les fromes non graves de la maladie est absente ou modeste, ne devenant appréciable qu’après la dose booster. L’effet de la vaccination des enfants aura au mieux un effet modeste sur les vagues delta et omicron. Le bénéfice collectif attendu de la vaccination des enfants ne peut être la raison principale de sa mise en œuvre, parce qu’il ne sera effectif que dans quelques mois (pour autant qu’une proportion importante des enfants reçoive deux doses. Ce n’est le cas ni aux États-Unis (<25% pour 1 dose, moins de 10% pour 2 doses), ni en Israël (<15%), ce indépendamment de problèmes de logistique.Si les enfants doivent être vaccinés c’est pour le bénéfice individuel qu’ils pourraient en tirer : poids de la maladie et des conséquences indirectes de la crise sanitaire sur leur quotidien notamment la fréquentation des écoles et des activités périscolaires.
Que sait-on de l’efficacité des vaccins entre 5 et 11 ans ? Dans l’étude ayant conduit à l’AMM européenne, l’efficacité du vaccin Pfizer a été évalué à 90 %. A la dose de 10 µg (le tiers de la dose adulte) les taux d’anticorps obtenus sont similaires à ceux de l’adulte jeune, laissant augurer une efficacité équivalente à celle de l’adulte quel que soit le variant. Cependant, une étude réalisée aux Etats-Unis a comparé l’efficacité du Comirnaty® administré chez des adolescents et des 5-11 ans sur l’infection à Omicron. Elle montre que sur Omicron, et comme on pouvait le prévoir (les doses administrées aux 5-11 ans étaient le tiers de celles injectées aux adolescents), l’efficacité chez l’enfant est plus faible et plus rapidement déclinante que chez l’adolescent. Ces résultats soulignent le besoin potentiel d'étudier des dosages alternatifs du vaccin pour les enfants.
Les sociétés savantes de pédiatrie sont-elles favorables à la vaccination des enfants de 5 à 11 ans ? Oui, elles se sont prononcées pour une vaccination rapide de tous les enfants présentant des maladies chroniques les exposant à un risque de forme grave de COVID ou vivant au contact de personnes immunodéprimées ne répondant pas à la vaccination. Elles soutiennent aussi les recommandations de vaccination des 5-11 ans sans comorbidités, émises par la Haute Autorité de Santé et le Conseil d’Orientation de la Politique Vaccinale ainsi que la position du Comité Consultatif National d’Éthique, en précisant les points suivants :
- La campagne de rappel vaccinal des adultes reste la priorité pour protéger les plus vulnérables, limiter les hospitalisations et les décès, la vaccination des enfants ne doit pas la freiner. La vaccination des enfants doit s’accompagner systématiquement d’une incitation forte à la vaccination des adultes de leur entourage proche si ces derniers ne sont pas correctement vaccinés.
- L’objectif premier de la vaccination des 5-11 ans est de leur apporter un bénéfice direct en leur assurant une protection individuelle contre les rares formes graves de COVID-19, notamment les syndromes inflammatoires multisystémiques pédiatriques (PIMS). Depuis avril 2020 en France, 373 enfants de 5 à 11 ans ont été hospitalisés pour un PIMS, le plus souvent en réanimation. Pour 80% d’entre eux, aucun facteur de risque ou comorbidité antérieure n’avait été identifié. Chez l’adolescent, une étude française récente montre qu’alors que ¾ des adolescents français ont reçu deux doses, sur la trentaine de cas de PIMS rapportés dans cette tranche d’âge, aucun n’est survenu chez des enfants complètement vaccinés. Nous manquons aujourd’hui de données précises quant à l’impact de la vaccination des enfants sur la dynamique des vagues épidémiques futures et l’obtention d’un effet de groupe.
- Les premières données de sécurité de la pharmacovigilance aux États Unis où de plus de 5 millions d’enfants ont reçu au moins une dose et 2 millions dans cette classe d’âge ont reçu 2 doses de vaccin sont très rassurantes. L’incidence des myocardites post vaccinale même après la deuxième dose est inférieure à 1/200.000 vaccinés et elles toutes eu une évolution favorable. Elles devront être confirmées et les pédiatres resteront très attentifs à l’exhaustivité des déclarations et du suivi de pharmacovigilance.
- La nécessité de la réalisation d’un TROD sérologique (en l’absence d’antécédent connu et documenté de Covid-19) lors de la 1ere dose vaccinale des enfants afin de limiter le schéma vaccinal à une seule dose en cas de contact antérieur avec le Covid-19.
- Dès maintenant, cette campagne de vaccination doit permettre d’offrir aux familles et aux enfants qui le souhaitent un accès large la vaccination en privilégiant dans un premier temps les collégiens.
- Pour tous les enfants de cette classe d’âge, la vaccination doit être proposée et non imposée, sans stigmatisation ni passe sanitaire ou vaccinal. Tous les enfants, vaccinés ou non vaccinés doivent pouvoir garder une vie scolaire, sportive et sociale de qualité même s’ils devront pour le moment continuer d’observer les mesures barrière en vigueur.
- Le rôle du pédiatre et du médecin traitant de l’enfant apparait déterminant pour guider les familles en vue d’une décision médicale partagée. En effet, une information éclairée des parents et des enfants devra être donnée tant sur le bénéfice direct attendu pour l’enfant que sur les incertitudes autour de la vaccination (efficacité, durée de protection selon les variants …) et de l’évolution de la pandémie.
- La démarche vaccinale doit permettre aux familles d’obtenir les réponses adaptées avec la mise en œuvre d’une logistique spécifique, proche des pratiques habituelles de vaccination de l’enfant, dans de bonnes conditions et sans précipitation afin que enfants et parents se sentent en confiance.
- Enfin une réflexion globale centrée sur la santé des enfants doit s’engager rapidement au décours de cette campagne pour compléter l’offre de prévention vaccinale pour d’autres maladies infectieuses avec un lourd fardeau pour les enfants et déjà disponible dans les autres pays Européens : rotavirus, coqueluche de la femme enceinte, méningocoques A-C-Y-W, varicelle.
Le programme de vaccination des enfants de 5 à 11 ans a-t-il été un succès en France ? Non contrairement à ce que l’on a pu observer chez les adolescents, le programme de vaccination des enfants de 5 à 11 ans contre le SARS-CoV-2 est un échec. Alors que plusieurs pays européens proches (Espagne, Portugal, Italie, Belgique …) ont des taux de couvertures vaccinales dépassant les 40%, moins de 5% des petits Français de cette tranche d’âge sont vaccinés, et plus inquiétant, moins de 10% des enfants à risque. Plusieurs explications peuvent être mises en exergue. La première est, à juste titre, que la COVID-19 est considérée en France comme une maladie bénigne chez l’enfant, ce qui nous a permis de maintenir les écoles ouvertes plus que dans n’importe quel pays. La seconde est que cette bénignité justifiait de disposer de données de « bonne » tolérance à large échelle, en vie réelle. Ces données, ainsi que les vaccins ont été disponibles début janvier 2022, au début de la vague Omicron en France. Très vite pour l’ensemble du corps médical et la population, il est apparu clairement que l’efficacité des vaccins, avant la dose booster, était médiocre vis-à-vis des infections non graves et de la transmission, mettant en doute l’intérêt de la vaccination. De plus, l’infection « naturelle » semblait possiblement plus efficace. Enfin, un nombre considérable d’enfants pour lesquels les parents souhaitaient la vaccination, ont contracté Omicron entre fin décembre et fin février. En outre, il ne faut pas oublier trois données fondamentales, historiques et non négligeables : l’hésitation vaccinale reste bien plus prégnante en France, le calendrier vaccinal de ces pays comporte des vaccins contre des maladies à faible mortalité infantile, comme les gastro-entérites à rotavirus ou la varicelle (ce qui n’est pas le cas chez nous), et enfin notre médecine scolaire qui aurait pu jouer un rôle important est malheureusement moribonde.
Se dirige-t-on vers la vaccination des jeunes enfants de moins de 5 ans ? Nul ne peut le dire à ce jour. L’idée a été renforcée par l’importance des hospitalisations des enfants de cette tranche d’âge lors de la vague Omicron (70% des hospitalisations pédiatriques) et des précisions sur l’étude du Comirnaty® chez les enfants de moins de 5 ans qui ont été données : la dose utilisée est de 3 µgr (1/10ème de la dose adulte, 1/3 de la dose des 5 à 11 ans) et l’étude a comporté près de 3.000 enfants. La tolérance a été considérée comme excellente, et l’immunogénicité, comparée à celle des 16-25 ans, était non inférieure pour les 6 mois-2 ans, mais étonnamment moins bonne chez les 3-4 ans faisant envisager la nécessité une 3ème dose.
La vaccination à grande échelle mise en place en Israël et en Grande Bretagne permet de disposer désormais de données sur l’efficacité des vaccins en vie réelle. En Israël, à partir du 7ème jour après la deuxième dose, le vaccin de Pfizer/BioNTech se montre efficace contre la COVID-19 ainsi que pour les infections sans symptôme, des résultats d'ailleurs homogènes pour l'ensemble des classes d'âge. Ceci suggère un effet probable de la vaccination contre la transmission du virus :
- Protection des personnes vaccinées contre une infection asymptomatique : 90% (IC à 95%, 83-94)
- Protection des personnes vaccinées contre une infection symptomatique : 94% (IC à 95%, 87-98)
- Protection des personnes vaccinées vis-à-vis d'une hospitalisation : 87% (IC à 95%, 55-100)
- Protection des personnes vaccinées vis-à-vis d'une maladie sévère : 92% (IC à 95%, 75-100)
Les études réalisées au Royaume-Uni ont par ailleurs évalué l’efficacité des vaccins d’AstraZeneca et de Pfizer chez les personnes âgées de plus de 65-70 ans, vis-à-vis des hospitalisations3,4. Un mois après la première dose, elle est de l’ordre de 73 à 85 % selon ces études et s’avère similaire pour les 2 vaccins. Cette donnée est d’autant plus précieuse qu’elle renseigne sur la persistance du même degré d’efficacité contre le variant dit « anglais », qui était majoritaire dans ces deux études et l’est désormais aussi sur le territoire français.
Un professionnel de santé s’est aperçu en fin de séance de vaccination qu’il avait administré une dose enfant du vaccin Pfizer à des patients adultes. Quelle est la conduite à tenir ? Les erreurs d’administration des vaccins sont inéluctables lors d’une campagne vaccinale d’une telle ampleur avec de nouveaux vaccins et mobilisant des acteurs très différents n’ayant pas toujours une grande expérience préalable en vaccination. Elles doivent être prévenues au maximum par la formation des vaccinateurs et le respect scrupuleux des procédures. Quelques soit l’erreur, deux règles sont fondamentales
1) D’abord et avant tout : déclarer ce cas en pharmacovigilance.
2) Prévenir les patients.
Le CDC a publié une conduite à tenir en fonction des erreurs les plus fréquentes.
|
Type d’erreur |
Erreurs |
Ne pas refaire de dose supplémentaire |
Refaire une dose immédiatement |
Refaire une dose à distance |
Contacter le laboratoire et/ou les autorités de santé |
|
Site |
Autre que le Deltoïde |
X |
|
|
|
|
Voie d’administration |
Sous cutané |
X |
|
|
|
|
âge |
|
|
|
|
|
|
Dosage |
Dose adulte à un enfant Dose enfant à un adulte |
X |
X |
|
|
|
Diluent |
Seulement le diluant Trop de diluant Pas assez de diluant Autre diluant que le sérum physiologique |
X
|
X X |
|
X |
|
Conservation impropre |
|
|
|
|
X |
|
Délai d’expiration dépassés |
|
|
|
|
X |
|
Intervalles |
Trop court (schéma initial) Trop long Trop court (booster) Administration d’anticorps |
X X X |
|
X |
|
|
Interchangeabilité |
|
X |
|
|
|
Le Comité d’orientation de la stratégie vaccinale a aussi publié un document sur les erreurs de dosage pédiatrique (Lien).
Le fait d’être vacciné diminue-t-il le risque de transmission en cas d’échec vaccinal ? OUI !!! Plusieurs études avaient montré qu'être vacciné réduisait le risque d'être infecté mais ne l’éliminait pas. Peu d’études avaient évalué l’impact direct de la vaccination sur le risque de transmission si la personne vaccinée développait malgré-tout la Covid-19. Une étude anglaise a évalué ce risque en comparant plus de 57 000 contacts de 24 000 ménages dans lesquels un cas confirmé en laboratoire avait été identifié chez une personne vaccinée, avec près d'un million de contacts de cas positifs chez des personnes non vaccinées. Les individus qui sont infectés 3 semaines après avoir reçu une dose du vaccin de Pfizer-BioNTech ou du vaccin d’AstraZeneca étaient entre 38 % et 49 % moins susceptibles de transmettre le virus à leurs contacts vivant sous le même toit que ceux qui n'étaient pas vaccinés. La protection a été observée à partir de 14 jours après la vaccination, avec des niveaux de protection similaires quel que soit l'âge des cas ou celui des contacts. Le domicile est un lieu à haut risque de transmission ; cette étude fournit des preuves de l'impact des vaccins sur la prévention de la transmission. Des résultats similaires peuvent être attendus dans d'autres contextes présentant des risques de transmission similaires, tels que les logements partagés, les Ephad ou les prisons.
Peut-on vacciner avec les vaccins à ARNm pendant la grossesse ? Oui !!! La grossesse est même devenue une indication. Les femmes enceintes avaient été exclues de principe, comme pour tous les nouveaux médicaments des études cliniques initiales et de ce fait il n’existait pas de données spécifiques les concernant. Depuis, des données ont été publiées, démontrant d’une part le risque accru de complications, de passages en soins intensifs, de décès dans le troisième trimestre de grossesse et d’autre part, la bonne tolérance, l’immunogénicité, et le passage des anticorps dans le sang du cordon et le lait de mère. Ceci laisse augurer d’un certain degré de protection des nouveau-nés et des petits nourrissons. Le mécanisme des vaccins à ARNm rend peu probable qu’ils présentent un risque particulier pour les femmes enceintes : il ne s’agit pas de vaccins vivants et ils sont rapidement dégradés par les processus cellulaires normaux, sans entrer dans les noyaux. Dans différents pays plus avancés que l’Europe en termes de vaccination contre la COVID (Israël, Angleterre, USA), aucun signal de pharmacovigilance n’a été détecté.
Il est désormais démontré que les femmes enceintes présentant une Covid-19 symptomatique sont plus à risque d’être admises en soins intensifs (x3) et de décéder (x1,7) (https://www.cdc.gov/mmwr/volumes/69/wr/pdfs/mm6944e3-H.pdf). Dans cette étude, les risques étaient majorés par l’âge (plus de 35 ans) ou l’existence d’une maladie cardiovasculaire.
Un groupe de travail à l’agence Européenne du médicament a analysé les données de près de 65 000 femmes enceintes vaccinées à différents stades de la grossesse. Cette revue n’a pas mis en évidence de risque accru de complications de la grossesse, de fausses couches, de naissances prématurées ou d'effets indésirables chez les bébés à naître après la vaccination avec des vaccins ARN. En outre, les effets indésirables les plus fréquemment rapportés par les femmes enceintes sont similaires à ceux déclarés dans la population générale et concernent des événements de réactogénicité.
Les vaccins à ARNm sont-ils contre-indiqués dans le premier trimestre de grossesse ? Non, la vaccination des femmes enceintes au 1er trimestre de grossesse n’est pas contre-indiquée ! Certes, seules les femmes enceintes à T2 et T3 ont été désignées comme cibles prioritaires, mais aucun signal de sécurité concernant la vaccination au cours de T1 n’a été détecté. Si la vaccination au 1er trimestre n'a pas été spécifiquement recommandée, c'est entre autre, par crainte que surviennent les successions d’événements [vaccination puis fausse couche], et que le lien chronologique soit interprété à tort comme un lien de cause à effet. Les fausses couches concernent environ 15 % des grossesses : 1 femme sur 4 est concernée au cours de sa vie, 3 à 4 000 fausses couches surviennent chaque semaine en France. Si l’on vaccine une grande proportion des femmes enceintes au 1er trimestre, on observera qu’une grande proportion des femmes faisant une fausse couche ont été vaccinées peu de temps avant. Conclusion : il est possible de vacciner les femmes en début de grossesse. Il n’y a pas de délai à respecter entre la vaccination et le début d’une grossesse.
La vaccination anti-COVID-19 pendant la grossesse protège-t-elle le bébé après la naissance ? Est-elle recommandée même si une sérologie post-infectieuse est positive ? Oui. La protection commence pendant la grossesse (elle prévient l’infection du placenta et ses conséquences potentiellement sérieuses) et continue après la naissance grâce au transfert d’anticorps maternels. Ce transfert nécessite du temps, d’où une vaccination préférentielle au 2ème trimestre sans sérologie préalable... et même si celle-ci était positive.
Le fait d'être vacciné permet-il de ne plus respecter les mesures barrières ? Non, malheureusement et contrairement à ce que l’on avait espéré. Avec les variants ∂ et Omicron, l’efficacité s’érode dans le temps n’empêchant pas de contracter des formes peu graves ou de transmettre la maladie. De ce fait, en période de remontée de l’épidémie comme cet automne en Europe, il ne parait pas prudent de ne pas respecter les mesures barrières en particulier en intérieur.
Pourquoi l’immunité́ post-vaccinale serait-elle meilleure que l’immunité post-infectieuse d’un COVID fait en 2020 ? L’infection COVID-19 induit une immunité très variable, dépendant des organes touchés et de la sévérité. Par exemple, une infection essentiellement ORL peut n’induire que peu ou pas d’IgG (la présence des IgA sur les muqueuses ne dépassant pas quelques mois), l’immunité étant généralement plus forte après COVID grave/prolongé. L’immunité induite par les vaccins ARN messager est bien plus homogène : les études israéliennes (ICI) montrent ainsi, ≥ 14 jours après la 2e dose, des taux d’efficacité très élevés avec des intervalles de confiance très étroits contre les décès (96.6% (95.1-97.6), les cas sévères ou critiques (97.9% (97.5-98.3), les hospitalisations (97.5% (97.1-97.9), les cas symptomatiques (97.6% (97.4-97-9) et même les infections asymptomatiques (94.1% (93.5-94.6).
Les patients greffés ou insuffisants rénaux ont-ils une réponse immunitaire suffisante ?
Non !!! Deux études ont été réalisées chez 242 greffés rénaux et 436 greffés d’organe solide, 20 à 28 jours après la première dose d’un vaccin ARN (Moderna ou Pfizer) : les anticorps anti spike n’étaient détectables que chez 10.8% et 17% des patients. Les éléments impactant positivement la réponse étaient une plus faible dose d’immunosuppresseurs, l’ancienneté de la greffe et l’absence d’utilisation d’anti-métabolite. Ces données soulignent l’importance de ne pas espacer chez les patients sévèrement immunodéprimés la deuxième injection de vaccin à ARNm au-delà de 28 jours, compte tenu du faible taux de réponse après la première dose chez les patients greffés. De plus, les dernières recommandations officielles précisent que l’injection d’une 3ème de vaccin à ARNm est nécessaire pour les personnes sévèrement immunodéprimées (transplantés d’organes solides, transplantés récents de moelle osseuse, patients dialysés, patients atteints de maladies auto-immunes sous traitement immunosuppresseur fort de type anti-CD20 ou anti-métabolites). Cette 3ème injection doit intervenir 4 semaines au moins après la deuxième dose, et dès que possible pour les personnes qui auraient déjà dépassé ce délai.
Quel délai doit ont respecter entre un traitement par immunoglobulines polyvalentes et la vaccination contre la COVID-19 ? Aucun !!! A l’heure actuelle, les quantités d’anticorps anti-SARS-CoV-2 contenus ne semblent pas susceptibles d'antagoniser le développement d'une réponse anticorps protectrice. Cette règle de délai s’applique essentiellement pour les vaccins viraux vivants (Rougeole, Oreillons, Rubéole, varicelle) à l’exception de la fièvre jaune.
Les traitements immunosuppresseurs contre-indiquent-t-ils les vaccins à ARNm ou vectorisés par un adénovirus ? Non ! Il ne s’agit pas de vaccins vivants. On peut craindre cependant une moindre immunogénicité-efficacité chez les patients recevant ce type de traitement mais le vaccin sera toujours probablement plus efficace que l’absence de vaccination. Des données montrant une très faible immunogénicité chez les transplantés d’organes et les dialysés sont maintenant disponibles, nécessitant de vacciner l’entourage et des stratégies renforcées (une 3e dose).
J’ai vacciné un couple qui a développé une COVID-19 (avec PCR +) 6 jours plus tard. Dois-je tout de même faire la 2e dose ? Oui. Pour le système immunitaire, il y a une seule exposition simultanée (infection+ vaccination). Donc proposer la vaccination comme s’il n’avait pas reçu la première dose : 3 mois après s’il s’agit d’immunodéprimé, 6 mois après dans le cas contraire pour bénéficier d’un effet « rappel ».
Un de mes patients de 65 ans, vacciné avec le Comirnaty® en Février et en Mars 2021, a présenté une COVID-19 peu sévère début septembre due au variant ∂. Dois-je lui proposer un rappel comme il est recommandé à cet âge ? NON !!! Cette infection peut être considérée comme un booster « naturel » et le répertoire immunitaire généré par cette séquence est possiblement encore plus large qu’avec un rappel vaccinal. Certains parlent, dans cette circonstance, d’immunité hybride ou de super-immunité.
Certains patients font des réactions inflammatoires extrêmement fortes à la première dose de vaccin ARNm... et sont ensuite réticents à faire la 2e dose. Que peut-on leur conseiller ? L’intensité de la réaction inflammatoire à une vaccination dépend de nombreux facteurs encore mal connus (génétique, microbiote, etc.), mais une très forte réaction fait suspecter une éventuelle exposition antérieure au virus SARS-CoV-2. Celle-ci peut être confirmée par une sérologie dirigée contre la protéine N (non contenue dans les vaccins). Si cette sérologie (non à la charge de l’assurance) est positive, elle permet de renoncer à la 2e dose, tout en obtenant un certificat COVID de vaccination après infection.
Les vaccins disponibles sont-ils interchangeables ? Au départ NON, car aucune donnée n’était disponible pour cette interchangeabilité et tout schéma vaccinal commencé avec un vaccin devait (si les vaccins sont disponibles) être continué avec le même : c’est ce schéma qui a été validé par les études cliniques et l’AMM. Cependant les vaccins à ARNm étant très proches, ils sont considérés maintenant comme interchangeables. Enfin des études d’interchangeabilité, plutôt des études de combinaisons de vaccins ou de stratégie de vaccination hétérologue entre les vaccins à ARNm et vectorisés ont été réalisées au Royaume Uni et dans divers pays. En Allemagne comme en France, on propose aux sujets de moins de 55 ans vaccinés par une dose de vaccin AZ de recevoir la 2e dose avec un vaccin ARNm 12 semaines plus tard. Cette technique, qui consiste à administrer en rappel un vaccin diffèrent de celui utilisé pour la primovaccination a été utilisée pour d’autres vaccins en pathologie expérimentale porte le nom de « Prime-Boost » hétérologue et donne des résultats d’immunogénicité dans certaines circonstances, au moins égaux au Prime-Boost homologue qui correspond. Une étude espagnole récente confirme pour le SARS-CoV-2 que la succession vaccin AstraZeneca puis Pfizer-BioNTech deux mois après, confère une excellente immunogénicité. Cependant, il faut noter que l’administration d’un autre vaccin contre la COVID en deuxième dose peut s’accompagner d’une augmentation de la réactogénicité immédiate à ce deuxième vaccin.
Que faire comme rappel à des patients vaccinés à l’étranger par le vaccin Sputnik V®. Les vaccins Sputnik sont des vaccins vectorisés sur deux adénovirus humains modifiés non-répliquant : adénovirus 26 pour la première dose (comme le vaccin Johnson&Jonhson) et adénovirus 5 pour la deuxième, pour éviter un éventuel effet « blunting ». Les données d’efficacité publiées dans le Lancet sont excellentes. Il n’y a pas de donnée spécifique pour une interchangeabilité de ce vaccin avec les autres. Mais les données dont nous disposons pour le vaccin AstraZeneca (lui aussi vectorisé sur un adénovirus) suivi d’un vaccin à ARNm deux mois après laissent penser qu’une seule dose de vaccin à ARNm sera suffisante.
Que faire comme rappel à des patients vaccinés à l’étranger par une dose le vaccin Sinofarm ? Le vaccin chinois Sinofarm est un vaccin inactivé entier. Les données d’efficacité et de tolérance sont moins bien connues que pour les autres vaccins. Il n’y a pas de donnée spécifique pour une interchangeabilité de ce vaccin avec les autres. Deux alternatives sont possibles :
- chercher une efficacité maximale en ne tenant pas compte de cette première dose et de pratiquer dans les délais habituels deux doses de vaccin à ARNm,
- espérer une réponse « hétérologue » comme pour les vaccins vectorisés sur adénovirus. Une étude chinoise semble le démontrer.
Quel délai doit-on respecter entre 2 doses de vaccins ? Quand l’approvisionnement des vaccins est suffisant, il faut respecter les délais recommandés par l’AMM car ce sont ces schémas qui ont été validés par des études cliniques : 3 à 4 semaines pour les vaccins à ARNm. Une souplesse de quelques jours est acceptable, toujours en reculant la date de la deuxième dose et jamais en l’avançant. En période d’approvisionnement difficile, le délai entre deux doses et la HAS, pouvait être porté jusqu’à 6 semaines. De plus, 10 j après la première dose, le taux de protection avec les souches de SARS-CoV-2 initiales était estimé pour le vaccin Pfizer-BioNTech à plus de 80%. Néanmoins, l’administration de la deuxième dose dans un délai raisonnable est nécessaire car les taux d’anticorps après 2 doses sont 10 à 100 fois plus élevés et des incertitudes sur la durée de protection persistaient. Pour le vaccin AstraZeneca, un délai de 12 semaines entre les deux doses semble augmenter l’efficacité par rapport à un délai de moins de 6 semaines. Cependant, l’émergence du variant ∂ pour lequel 2 doses sont nécessaires ont conduit les autorités britanniques à rapprocher les 2 doses du vaccin AZ entre 6 et 8 semaines. En effet, en Angleterre, l’efficacité sur toutes les formes de Covid était moins bonne avec 1 dose que 2 doses et avec l’AZ que le vaccin Pfizer. La HAS s’est prononcée sur la recommandation d’administrer un vaccin ARNm, 4 semaines après le vaccin AZ, quel que soit l’âge, pour augmenter la protection contre le variant delta. Par contre, pour obtenir un effet booster de cette troisième dose, un délai > 5 à 6 mois est nécessaire.
J’ai entendu dire qu’un vaccin contre la COVID-19 avait démontré une bonne efficacité en une seule dose ? Oui…avant l’émergence des variants moins sensibles aux vaccins…Janssen vaccins (ou Johnson&Johnson) a obtenu l’AMM aux Etats Unis et en Europe, pour un vaccin vectorisé sur un adénovirus (ad26) humain peu répandu et sans pouvoir pathogène connu non répliquant. Il était recommandé en France chez les sujets de 55 ans et plus. Dans une étude comparatif versus placebo comportant près de 40.000 patients, l’efficacité à 28 jours après une seule dose était de 66.9% (IC95% = 59.0-73.4) pour toutes les formes de COVID et de 85.4% (IC 95%= 54.2-96.9) pour les formes graves, le tout avec une tolérance acceptable. L’efficacité contre les infections asymptomatiques a été estimée à 65,5% (IC95% =39.9-81.1). Ce vaccin administrable en 1 seule dose autorise une conservation de plusieurs mois entre 2°C et 8°C comme les vaccins habituels. Une partie de l’étude ayant été réalisée en Afrique du Sud, une efficacité clinique a été démontrée pour les variants sud-africains (un des plus résistant aux vaccins) : 64% pour les formes cliniques habituelles, et 81,7% pour les formes graves. Le risque de syndrome thrombose-thrombopénie induite par la vaccination (TTIV) a été particulièrement surveillé et a justifié une pause dans son utilisation aux Etats-Unis, le premier pays occidental à l’administrer. Le C.D.C. a retrouvé 28 cas sur près de 10 millions de vaccinés : l’immense majorité des cas (22/28) concernent des femmes, 18 d’entre elles avaient moins de 50 ans. Le risque global de développer un TTIV est extrêmement faible paraissant inférieur au vaccin AZ : 1/300.000 au global, environ 1 cas/100.000 chez les femmes âgées de 18 à 49 ans. Depuis Juillet 2021, la survenue de syndrome de Guillain- Barré est reconnu comme un effet indésirable possiblement lié à ce vaccin. Son incidence est estimée aux USA à moins de 1 à 2 cas pour /1.000.000 de vaccinés. Enfin, l’émergence du variant ∂ fait que maintenant, une deuxième dose est recommandée avec un vaccin à ARNm.
Spikevax® ou Comirnaty® ? Les différences de doses entre les vaccins de Moderna (3 fois plus dosés en ARNm) et de Pfizer ont des conséquences non seulement en termes d’immunogénicité et d’efficacité sur le ∂ (le 1er apparaissant plus immunogène et plus efficace) mais aussi en termes de tolérance. Une étude confirme que le Spikevax® provoquerait plus de myocardites et péricardites chez les sujets jeunes. De ce fait, la HAS ne recommande plus le Spikevax® chez les moins de 30 ans. On espère que les futures recommandations privilégieront : le Spikevax® aux sujets dont l’immunogénicité est la moins bonne ou la moins durable, le Comirnaty® pour les autres.
Doit-on s'inquiéter d'une augmentation des syndromes de Kawazaki « like » PIMS ou MIS-C (Paediatric Multisystem Inflammatory Syndrome ou Multisystem inflammatory syndrome in children) chez les enfants recevant le vaccin COVID-19 ? L'une des raisons pour lesquelles on effectue des essais de vaccins chez les enfants est de s'assurer qu'ils n'ont pas d'effets secondaires spécifiques à la pédiatrie. Des cas de PIMS survenant également chez les jeunes adultes, le renforcement actuel de la pharmacovigilance (plus d’un milliard de personnes ont été vaccinés) aurait permis de repérer une problématique si elle existait. Il n'y a pas de biomarqueur connu pour prédire une réponse immunitaire qui mène au PIMS. L’hypothèse la plus probable est que la protection contre la COVID-19 protègera également contre ces syndromes. Plusieurs millions d’adolescents ont été vaccinés avec deux doses de vaccin sans qu’un signal de pharmacovigilance n’ait été détecté.
Le Covid Long est-il fréquent chez l’enfant ? Non !!! Cependant des symptômes prolongés post-COVID-19 ont été décrits chez les adolescents et plus rarement chez les enfants, mais dans une proportion bien moindre que chez l’adulte. Une méta-analyse de 14 études internationales portant au total sur 19.426 enfants et adolescents ayant signalé des symptômes persistants du COVID-19, montre que :
- la fréquence semble bien moins importante que chez les adultes (2-5% pour les études avec un groupe contrôle),
- les symptômes (plus rapidement résolutifs que chez l’adulte) sont des motifs fréquents de consultation dans la population pédiatrique, en dehors de toute infection COVID.
Une autre méta-analyse confirme que la plupart des symptômes persistants sont aussi fréquents dans le groupe contrôle que dans le groupe infecté par le SARS-CoV-2
Les signes d’appel sont : fatigue, maux de tête, troubles du sommeil, difficultés de concentration, arthromyalgies, douleurs abdominales, intolérance à l’effort, anosmie-agueusie persistante et signes respiratoires. Les symptômes sont souvent intriqués et peuvent impacter la vie quotidienne de l’enfant (diminution des activités habituelles, décrochage et/ou absentéisme scolaire). Même si les enfants, plus souvent des adolescents, ne sont pas nombreux à souffrir de symptômes prolongés, il est indispensable de les prendre en charge efficacement afin de minimiser le retentissement sur leur vie quotidienne et celle de leur famille. Une écoute attentive du patient et de la famille permet dans une grande partie des cas de les rassurer sur la bonne évolution attendue dans un temps court.
Le fait de présenter depuis quelques mois des symptômes évocateurs de COVID long est-il une contre-indication à la vaccination ? Non au contraire… Dans l’état actuel des connaissances scientifiques, il n’y a pas de contre-indication à la vaccination des patients présentant des symptômes prolongés de la covid-19. Au contraire, dans le cas de symptômes prolongés de la covid-19 liés à une infection non contrôlée, la vaccination pourrait même contribuer à la guérison. D’après une étude sur la tolérance du vaccin de Pfizer, le fait de souffrir ou d’avoir souffert de « Covid long » n’était pas associé à une mauvaise tolérance du vaccin. Chez 44 patients souffrant de « Covid long » et vaccinés, une absence d’aggravation voire une amélioration de la qualité de vie étaient le plus souvent rapportées à 1 mois ? La même équipe a communiqué les résultats d’une enquête menée auprès de 812 personnes : après la 1ère dose de vaccin, 56,7 % rapportaient une amélioration de leurs symptômes, 24,6 % une absence de modification et 18,7 % une aggravation (étude non publiée). Au total, une dose unique de vaccin peut donc être administrée à partir de deux mois après le début de l'infection chez les personnes souffrant de symptômes prolongés.
Peut-on administrer la deuxième injection de Comirnaty® à une personne d’une trentaine d’années ayant présenté, 12 h après sa première injection de Pfizer, de multiples ganglions sensibles au niveau des aisselles et des seins ? OUI !!!
L’apparition de ces ganglions est une réaction post-vaccinale fréquente qui témoigne de la mise en route du système immunitaire et qui ne contre-indique en rien l’injection suivante.
Les vaccins à ARNm augmentent-ils le risque de troubles menstruels ? Les réseaux sociaux ont relayé de fausses informations concernant fertilité et vaccination Covid-19. Un phénomène qui participe à l'inquiétude du grand public quant aux troubles menstruels constatés post-vaccination. Des modifications des règles après vaccination Covid-19 ont été fréquemment rapportées aux différents systèmes de pharmacovigilance, par exemple français, anglais, américain… En l’absence de données comparatives de personnes non vaccinées, il est impossible d’affirmer/infirmer que des modifications des règles sont causées par la vaccination. Les Instituts nationaux de la santé américains (NIH) et l'Institut norvégien de la santé publique publient des preuves rassurantes. 1/ Les auteurs américains (ref 1) ont tiré parti d'une application déjà existante de suivi du cycle menstruel : 3959 Américaines ont enregistré au moins six cycles consécutifs ; 2403 d'entre elles ont été vaccinées et les autres ont constitué le groupe témoin. Dans les modèles ajustés, la 1ère dose de vaccin n'avait aucun effet sur les règles suivantes, tandis que la 2ème dose était associée à un retard de 0,45 jour. Parmi les 358 qui ont reçu les deux doses du vaccin au cours du même cycle, 10,6 % ont eu une modification de la durée du cycle de plus de 8 jours (considérée comme cliniquement significative), contre 4,3 % dans la cohorte non vaccinée (P<0,001). Dans tous les groupes, la longueur des cycles est revenue à la normale deux cycles après la vaccination. 2/ Les auteurs norvégiens (ref 2) ont quant à eux questionné une cohorte préexistante (N = 5 688) au sujet d’éventuels changements menstruels au cours des cycles précédant et suivant l'administration de chaque dose de vaccin. Le niveau élevé de variation des cycles normaux est souligné par le fait que 38 % des participantes ont signalé au moins un changement par rapport à la normale, même dans les cycles précédant la vaccination. L'étude a identifié des saignements plus abondants que la normale comme étant le changement le plus associé à la vaccination (risque relatif de 1,9 et 1,8 après la 1ère et la 2ème dose respectivement).
L’hypothèse la plus plausible serait que la réponse inflammatoire post-vaccinale pourrait, comme d’autres réactions inflammatoires, déréguler transitoirement l'axe hypothalamo-hypophysaire.
Si, des modifications du cycle menstruel semblent bien se produire après la vaccination, elles sont faibles par rapport à la variation naturelle, s'inversent rapidement et ne remettent pas en question les bénéfices de la vaccination.
Les variants inquiétants (VOC) comportent tous des dizaines de mutations, et le plus souvent on ne parle que de celles qui touchent la spike. Les autres ne jouent aucun rôle pour rendre le virus plus transmissible ? Non !!! Les mutations touchant la partie la plus fonctionnelle de la spike ont été considérées comme celle qui avaient le plus grand impact sur l’augmentation de la pathogénicité du SRARS-CoV-2. Ce n’est peut-être pas complètement vrai. En effet, une étude anglaise montre qu’une ou deux des 23 mutations du variant permet d’affecter la réponse immune de l’hôte en réduisant la production d’interféron , le rendant transitoirement invisible au système immunitaire en lui permettant de produire de plus grosse quantité d’un gène appelé Orf9b dont la protéine se fixe sur un récepteur protéique humain (Tom70) limitant la libération d’interférons et réduisant la réponse immunitaire.
Les mutations du virus (en particulier les variants) peuvent-elles affecter l’efficacité des vaccins SARS CoV-2 ? OUI des mutations touchant des régions de la spike peuvent compromettre l’immunité vaccinale. Les données fournies par les firmes sur la capacité des sérums de sujets vaccinés à inhiber les variants sont plutôt rassurantes. Les anticorps induits par la vaccination sont dirigés contre les souches ancestrales qui ont été choisies pour sélectionner les ARNm présents dans les vaccins. Ils ont naturellement plus d’affinité pour la « spike » des souches ancestrales que pour celles des variants. Il faut donc pour les « neutraliser » des taux d’anticorps plus élevés, mais qui restent inférieurs à ceux qui sont obtenus dans les semaines qui suivent la 2ème dose et plus encore à ceux retrouvés après le booster. De nombreuses études en Angleterre, au Qatar, en Israël montrent que globalement
- les vaccins protègent beaucoup mieux des formes graves que des formes bénignes ou de la transmission
- Les sujets jeunes sont mieux protégés que les plus âgés
- L’efficacité s’érode avec le temps
Il y a peu de chances que l’on ait un jour un variant pour lequel les vaccins n’exerceront aucune protection et qui bénéficie d’une haute transmissibilité.
Les vaccins à ARNm augmentent-ils le risque de myocardites ou péricardites aiguës (MPA)? Oui !!! Les MPA sont « naturellement » des maladies rares (incidence annuelle attendue aux alentours de 1/100.000 chez l’enfant). On considère qu’il s’agit le plus souvent de maladies qui surviennent au décours d’une maladie virale, majoritairement chez les adolescents (pic entre 15 et 18 ans) et 7 fois sur 10 chez les garçons.
Des cas MPA d’évolution favorable au décours de l’administration de vaccins à ARNm ont été rapportés. En Israël, où le programme de vaccination a débuté il y a 11 mois, le risque de myocardite-péricardite après Comirnaty® a été bien décrit.
Plusieurs autres publications (1,2,3,4) en soulignent les caractéristiques cliniques :
- L’incidence en post-vaccination (comparée à celle des MPA « naturelles ») est significativement augmentée uniquement chez les sujets jeunes.
- Elles affectent principalement des jeunes de sexe masculin âgés entre 12 et 30 ans.
- Elles surviennent majoritairement après la seconde dose vaccinale, généralement dans un délai de 2 à 7 jours après cette dernière.
- Elles associent de façon variable douleurs thoraciques, palpitations, syncope, tachypnée, fièvre, frottement péricardique, vomissements, anorexie, léthargie.
- Les examens complémentaires (ECG, Échographie, troponine) permettent le diagnostic.
- A court et à moyen terme, elles paraissent bénignes. Cependant pratiquement tous les patients ont été hospitalisés (souvent de principe) et la plupart ont été traités par corticothérapie et/ou anti-inflammatoires et/ou immunoglobulines.
Leur incidence pour les 12-17 ans est estimée aux USA pour la deuxième dose de vaccin entre : 1/15.000 et 20.000 chez les garçons et 1/100.000 à 1/150.000 chez les filles
Le Spikevax® est plus susceptible d’en provoquer que le Comirnaty® expliquant que le vaccin de Moderna n’est plus recommandé avant l’âge de 30 ans en France.
Les MPA post-vaccinales sont maintenant reconnues par les agences sanitaires américaines et Européennes comme un évenement indésirable lié aux vaccins à ARNm.
Ces résultats (en attendant des données plus complètes) doivent amener les autorités à préciser :
- L’importance de la sérologie au moment de la première dose (par un TROD sérologique) pour les sujets jeunes, chez lesquels prédominent de nombreuses formes pauci ou asymptomatiques : si une dose est suffisante, autant n’en faire qu’une.
- La sensibilisation des médecins pour dépister tôt les MPA post-vaccinales car les signes initiaux sont relativement modestes.
Le vaccin COVID 19 de Novavax (Nuvaxovid® ou NVX-CoV2373) a été autorisé par la Commission Européenne, après que L’EMA a recommandé son utilisation le 20/12/2021. Il diffère des vaccins actuellement disponibles : c’est un vaccin sous unitaire constitué de nanoparticules de glycoprotéines Spike recombinantes du SARS-CoV-2 adjuvantées par Matrix-M1. Il induit une forte réponse immunitaire en primo vaccination et dans un essai randomisé multicentrique, contre placebo conduit au Royaume-Uni, l’efficacité vaccinale a été estimée à 89,7 % (IC95%, 80,2 à 94,6) comparable aux vaccins à ARNm. Le schéma vaccinal comporte 2 doses espacées de trois semaines. Il permet aussi une forte réponse immunitaire lorsqu’il est administré en boost (essai CovBoost).
Si vous voulez en savoir plus sur ce vaccin cliquez ici pour lire l’excellent du Vidal actualités.
Ces derniers jours, la firme a communiqué sur l’efficacité (bonne) du Nuvaxovid® chez l’adolescent.
La réaction immunitaire induite par l’ARNm des vaccins peut-elle aller jusqu’à l’orage cytokinique chez certains vaccinés ? Non !!! La réaction immunitaire à une infection virale ou bactérienne concerne le plus souvent, non un antigène (comme pour la réponse contre la « spike » induite par les vaccins ARN) mais plusieurs antigènes et elle est bien plus complexe, incluant aussi d’autres mécanismes immunitaires. De plus, la réaction cytokinique induite par l’infection à SARS-CoV-2 survient 2 à 4 semaines après l’infection, or sur les milliards de vaccinés avec les vaccins Pfizer ou Moderna, ces réactions n’ont pas été rapportées.
Faut-il s’inquiéter des variants Omicron (B.1.1529) ? La réponse est OUI. Les sous-linéages du variant « Omicron » ne sont pas des évolutions des variants préoccupants précédents (a , ß, d ou ∂) : Omicron appartient à une autre « branche » phylogénétique dont l’ancêtre est la souche Wuhan. L’évolution s’est faite à « bas bruit » sur une longue période sans être repérée par les systèmes de surveillance. La cinquantaine de mutations issues de cette évolution pourrait être la conséquence du passage des virus chez des immunodéprimés (nombreux en Afrique du Sud du fait de l’incidence du VIH) ou chez des hôtes animaux.

Les variants Omicron ont une configuration inquiétante avec des mutations du ∂ pour la transmission, des mutations du ß pour la résistance à l’immunité, associées à de très nombreuses autres mutations sur la spike et l’insertion d’autres gènes provenant d’autres coronavirus humains.
Différentes études portant sur Omicron le situent par rapport au variant ∂. Il a :
- une plus grande contagiosité, amenant le R0 > 10 possiblement au même niveau que celui de la rougeole, avec un intervalle intergénérationnel extrêmement court. En Afrique du Sud, Angleterre, Danemark, les temps de doublement de l’épidémie Omicron n’ont jamais été aussi courts (2 à 3 jours) expliquant que ces variants sont devenus prédominants en quelques semaines. Cette grande transmissibilité passe probablement par une transmission « air » encore plus efficace. Ceci impose des mesures synergiques pour contenir cette épidémie.
 - Une plus grande résistance à l’immunité naturelle post infection ou acquise après la primovaccination.
- Une plus grande résistance à l’immunité naturelle post infection ou acquise après la primovaccination.
- Possiblement une moindre sévérité qui s’explique par l’immunisation d’une forte proportion de la population et par le moindre tropisme pulmonaire.
Existe-t-il différents sous-types de variants Omicron ? Oui !!! Il existe trois sous-lignages désignés BA.1 (majoritaire initialement), BA.3 (très peu détecté) et BA.2, devenu prédominant d’abord au Danemark, et dont la proportion augmente également en France et dans le monde. Ce dernier comporte 8 mutations de la protéine spike qui lui sont propres, et n’a pas la délétion Δ69-70, qui permet à certaines techniques de criblage de repérer le variant Omicron. Le sous-variant BA.2 est plus transmissible que BA.1., avec un intervalle de temps entre l’infection des cas index et celle des sujets contacts plus court (3,3 jours en moyenne versus 3,7 jours pour BA.1 d’après Public Health England) et un taux d’attaque secondaire supérieur, ce qui signifie qu’un cas index contamine plus de personnes (Ref1). Cette plus forte transmissibilité pourrait être expliquée par le fait que BA.2 se multiplie plus que BA.1 dans des cultures primaires de cellules épithéliales nasales (Ref2).
Selon l’OMS et les premières données disponibles chez l’homme, il ne semble pas y avoir de différence de sévérité de la maladie causée par BA.1 ou BA.2.
Enfin, les données préliminaires concernant l’échappement immunitaire sont pour le moment contradictoires : certaines études trouvent que la baisse du pouvoir neutralisant des anticorps est du même ordre de grandeur avec BA.1 et BA.2 par rapport aux variants précédents (Ref3) tandis que d’autres décrivent un échappement immunitaire plus marqué avec BA.2, en particulier une possible perte de l’efficacité du seul anticorps monoclonal qui conservait une activité importante contre Omicron, le sotrovimab ou Xevudy® (Ref4).
D’après SpF et les épidémiologistes de l’Institut Pasteur, le sous-variant BA.2 d’Omicron ne devrait pas être à l’origine d’un rebond épidémique du fait des fortes couvertures vaccinales et de l’immunité protectrice conférée par l’infection par BA.1 vis-à-vis de BA.2, dans un contexte chronologique favorable puisque, contrairement à ce qui s’est passé au Danemark, la progression de BA.2 survient de manière très décalée par rapport à la vague Omicron BA.1 (Le Monde).
Les vaccins à ARNm disponibles protègent-t-il du variant Omicron ? Oui mais avec une efficacité diminuée, en particulier sur les formes non graves, chez les personnes âgées et avec comorbidités ! Plusieurs études avaient montré que la capacité neutralisante du sérum de primo-vaccinés avec deux doses était 10 à 40 fois inférieure pour Omicron ; le pouvoir neutralisant du sérum de convalescents était également significativement diminué (1,2,3). Le maintien du pouvoir neutralisant est meilleur chez les personnes qui ont été à la fois infectées et complètement primo-vaccinées (2 doses). L'administration d'une dose de rappel Pfizer ainsi que la vaccination d'individus précédemment infectés permettraient de générer une réponse neutralisante suffisante contre Omicron (4, 5). Une étude montre néanmoins que ce taux d’anticorps post 3ème dose diminue dès 3 mois, mais des données à plus long terme sont nécessaires. A partir de ces résultats, une modélisation a permis d’estimer la protection assurée par un vaccin ARNm : six mois après deux doses elle serait d’environ 40 % contre l'infection symptomatique et 80 % contre les formes sévères ; la dose de rappel « booster » augmenterait cette protection à 86 % contre l'infection symptomatique et 98 % contre les formes sévères.
Une autre étude montre que le schéma en 2 doses du Comirnaty® a peu d’effet neutralisant sur le variant Omicron ; par contre, après la dose booster, le pouvoir neutralisant serait multiplié par 25 et redeviendrait comparable à celui obtenu après 2 doses sur les souches ancestrales. Cette étude précise aussi que 80% des épitopes de la Spike du variant Omicron reconnus par les CD8 sont peu affectés suggérant qu’après la primovacination la protection contre les formes graves serait maintenue. Une étude anglaise suggère qu’après 2 mois, un schéma de vaccination initial par 2 doses de Pfizer ou d’AstraZeneca ne protègerait pas ou peu contre les formes modérées mais que l’efficacité vaccinale 15 jours après une dose de rappel remonterait à 70-75%. Enfin, le dernier rapport des autorités anglaises « en vie réelle » confirme ces données mais suggère d’une part une efficacité plus grande pour le Spikevax, et d’autre part une tendance à la diminution de cette efficacité, 10 semaines après le booster. En résumé, la primovaccination confère une protection contre l’infection modeste et peu durable (quelques semaines), mais considérablement améliorée (pendant quelques semaines ou mois) par le rappel. En revanche, l’immunité cellulaire, moins dépendante des mutations sur la zone RBD (Receptor Binding Domain) maintient une bonne protection contre les formes graves.
Les variants Omicron induisent-ils des formes moins graves de Covid-19 ? Oui !!! Il y a une dissociation entre le nombre de cas diagnostiqués qui augmente de façon exponentielle et le nombre d’hospitalisations, de séjours en soins critiques et décès qui croît mais de façon nettement moins rapide. Ceci s’explique en partie par le moindre tropisme pulmonaire d’Omicron, mais doit être tempéré par deux points : le premier est que l’accès aux méthodes diagnostiques (notamment les antigènes) est beaucoup plus rapide et large (notamment pour le dépistage avant des réunions), le second, que cette nouvelle vague survient sur des populations en partie protégées par la vaccination et/ou une maladie antérieure.
Malgré la réputation de bénignité d’Omicron, le nombre de morts ne baisse pas en France et dans plusieurs pays occidentaux. Comment l’expliquer ? Ceci s’explique par l’intensité des contaminations qui n’a jamais atteint ce niveau et par la sensibilité des plus fragiles à ces variants malgré la vaccination. Les risques résiduels sont fortement liés à un âge élevé, à la prise de traitements immunosuppresseurs ou corticoïdes oraux, à la présence de plusieurs comorbidités : obésité, diabète, trisomie 21, retard mental, transplantation rénale ou pulmonaire, insuffisance rénale chronique terminale en dialyse ou le cancer actif du poumon (données EPIPHARE).
Les anticorps monoclonaux sont-ils actifs sur les variants Omicron ? Les données préliminaires montrent une perte complète de l’efficacité de la combinaison casirivimab/imdevimab (Roche/Regeneron) ou bamlanivimab/etesevimab (Lilly) et une conservation partielle de l’efficacité de l’association tixagevimab/cilgavimab (AstraZeneca), indiquée en prévention primaire chez les immunodéprimés. Le sotrovimab (Vir/GSK) semblerait conserver son efficacité de neutralisation puisque sa cible est un domaine très conservé de la protéine spike. Enfin, le médicament par voie orale paxlovid (Pfizer) devrait être efficace car dirigé contre la protéase du virus qui est peu modifiée, mais ce produit ne sera disponible qu'à partir de février 2022 (Conseil scientifique, 16/12/2021).
Les patients infectés par OMICRON BA1 peuvent-ils s’infecter par le BA2 ? Très probablement non. Les différences structurelles entre les deux sous-linéages sont relativement modestes (pas plus que les pour les souches ancestrales et les variants alpha) et une étude Israélienne ne retrouve aucune infection à BA2 chez des sujets infectés par le BA1.
La transmission d’Omicron entre les enfants est-elle plus importante que pour la souche ancestrale ou les variant inquiétants précédents ? Oui !!! Omicron a entrainé une augmentation considérable de l’incidence des cas chez l’enfant ainsi que des hospitalisations pédiatriques sans précédent dans les pays occidentaux, sans doute en raison de sa transmissibilité extrêmement élevée (R0 > 10 et transmission « air ») et de l'absence de vaccination des enfants ce qui les rend plus vulnérables que les adultes vaccinés depuis des mois.
Les chiffres d’hospitalisations pédiatriques donnés par Santé Publique France, impressionnants par rapport aux vagues précédentes, peuvent sembler inquiétants mais :
- Les données fournies par le réseau GPIP-SFP montrent que 40 à 60 % des cas hospitalisés sont des Covid « fortuits ou accessoires », ce que SPF ne peut pas évaluer précisément. Même en réanimation et soins intensifs, 1/3 des cas Covid sont fortuits ou accessoires.
- Au Royaume-Uni, les estimations montrent que le risque individuel d'hospitalisation d'un enfant infecté par Omicron est inférieur - d'un tiers à la moitié - à ce qu'il était lorsque Delta était dominant.
- Plus de 70 % des enfants hospitalisés ont moins de 5 ans et la majorité d’entre eux moins d’un an : cette vague d’hospitalisations « Omicron » a touché particulièrement les nourrissons. Moins de 15 % des enfants hospitalisés ont entre 5 et 11 ans.
- Les enfants hospitalisés ne présentent pas de maladie plus grave que ceux infectés par les variants précédents ; si parfois la symptomatologie est bruyante, elle est courte et il y a eu moins de ventilation mécanique et de besoins en oxygène.
- Au 10 février 2022, on ne note pas d’augmentation du nombre de cas de PIMS en France. Au Royaume-Uni qui nous a précédé de 2 semaines pour la vague Omicron, bien qu’un petit nombre de cas de PIMS liés à ces variants ait été rapporté, il n’y a pas eu d’augmentation du nombre de cas. Ceci contraste avec l’intensité de la vague d’infections et plaide pour une plus faible capacité d’Omicron à provoquer des PIMS.
La mortalité, contrairement à des chiffres extravagants circulant dans les médias reste extrêmement faible depuis la vague Omicron.
Les vaccins contre la COVID-19 provoquent-ils des paralysies faciales (PF) ? Les PF sont secondaires à une inflammation du nerf facial, notamment au niveau du trou stylo-mastoïdien souvent au décours d’une infection virale (Herpes, varicelle, EBV…parfois bactérienne (Lyme…). Sous corticothérapie précoce, courte et intense, 80% guérissent sans séquelle en moins de 2 mois. De nombreux cas de PF ont été rapportés aux systèmes de pharmacovigilance de différents pays et pour différents vaccins. Pour l’instant, aucune autorité de santé n’a considéré que cet effet indésirable était imputable aux vaccins. En effet, l’incidence de cette affection étant élevée, il ne semble pas que le nombre de cas décrits après vaccination soit supérieur à celui qui était attendu en population générale. Cependant, une étude cas témoin réalisée à Hong-Kong retrouve un risque significativement augmenté {AORs= 2·38 (IC 95% 1·415)} après le vaccin Sinovac® (vaccin entier inactivé) mais pas après le Comirnaty® (AOR = 1·75 (0·88 to 3·47). Les mécanismes invoqués sont soit un phénomène d’auto-immunité soit une réactivation d’un herpes simplex. Quoi qu’il en soit, le faible risque et bénignité de l’affection ne remettent pas en cause la balance bénéfice / risque et ne contre-indique pas l’injection de la deuxième dose.
Les vaccins contre la COVID-19 provoquent-ils des Syndromes de Parsonage et Turner ? Peut-être ! Bien que rares (moins de 80 cas en France), les SPT sont actuellement considérés comme un signal potentiel pour l’ensemble des vaccins contre la Covid-19 et font l’objet d’un suivi spécifique. Jusqu’à présent, il ne ressort pas de caractéristiques particulières en termes de rang vaccinal, de délai de survenue ou d’évolution. Ce syndrome, appelé aussi névralgie amyotrophiante de l’épaule est une pathologie peu fréquente, caractérisée par une violente douleur suivie d'une paralysie du bras et dont la physiopathologie est mal connue. Différents facteurs ont été mis en cause comme des infections virales (des cas sont décrits notamment en post infection covid) ou bactériennes, une chirurgie ou la vaccination antigrippale. Le STP touche majoritairement des hommes (sex-ratio à 2), et préférentiellement dans la catégorie d’âge 45-64 ans.
Un homme de 25 ans a développé une péricardite J3 après la première dose de Comirnaty®. L’évolution est lente et favorable. La question de procéder au rappel de ce vaccin se pose ? A notre sens, il est préférable de différer en attendant plus de données !!! Tant en Israël qu’aux États-Unis, ces péricardites et myocardites post-vaccinales sont observées essentiellement chez les garçons jeunes (<30 ans), 2 à 4 jours après la deuxième dose et sont reconnues comme des réactions indésirables, probablement imputables aux vaccins à ARNm. Le fait que votre patient ait fait une péricardite 3 jours après la première dose interroge sur une éventuelle séropositivité préalable à la vaccination (les formes pauci et asymptomatiques étant très fréquentes chez les jeunes). Il suffit de lui faire une sérologie dosant les anticorps contre les nucléoprotéines pour le savoir (le vaccin ne fait monter que les Ac anti-spike).
Le CDC a émis des recommandations qui risquent d’évoluer rapidement.
Pour l’instant
- Pas de contre-indication concernant les vaccins ARN pour les personnes ayant un antécédent de myocardite/péricardite antérieur à la vaccination ;
- Si une péricardite survient après la 1èredose, il est conseillé d’attendre une résolution complète avant de réaliser la 2nde;
Si une myocardite survient après une 1ère dose, il est conseillé de différer la 2nde jusqu'à ce qu'on en sache plus sur le lien avec le vaccin.
La vaccination est-elle efficace en post-exposition ? Très probablement non, compte tenu de la période d’incubation courte de la Covid-19 (5 jours en médiane) et du délai entre la 1ère dose vaccinale et la protection conférée par les vaccins (2 à 3 semaines).
Peut-on vacciner contre la COVID-19, une femme qui vient de recevoir, en post-partum immédiat, une injection de Rhophylac® (Anticorps anti-D) pour prévenir une incompatibilité rhésus ? Oui !!! et sans aucun doute : on sait depuis des années que ce produit ne contre-indique plus les vaccins y compris les vaccins vivants (comme le ROR) du fait des faibles concentrations d’anticorps contre ces maladies. En outre, il est recommandé depuis plusieurs mois de vacciner les femmes enceintes et allaitantes contre la COVID-19.
Les vaccins à ARN sont-ils contre-indiqués dans le premier trimestre de grossesse ? Non, la vaccination des femmes enceintes au 1er trimestre de grossesse n’est pas contre-indiquée ! Certes, seules les femmes enceintes au 2ème et 3ème trimestre ont été désignées comme cibles prioritaires dès le 3 avril 2021, mais aucun signal de sécurité des vaccins au cours du 1er trimestre n’a été détecté. Si la vaccination au 1er trimestre n'a pas été spécifiquement recommandée, c'est – entre autres – par crainte que surviennent les successions d’événements [vaccination puis fausse couche], et que le lien chronologique soit interprété à tort comme un lien de cause à effet. Les fausses couches concernent environ 15 % des grossesses : 1 femme sur 4 est concernée au cours de sa vie, 3 à 4 000 fausses couches surviennent chaque semaine en France. Si on vaccine une grande proportion des femmes enceintes durant le 1er trimestre, on observera qu’une grande proportion des femmes faisant une fausse couche ont été vaccinées peu de temps avant. L’émergence du variant ∂ et sa très grande transmissibilité change la donne. Conclusion : il faut vacciner les femmes en début de grossesse et il n’y a pas de délai à respecter entre la vaccination et le début d’une grossesse.
Les vaccins COVID-19 confèrent-ils une protection collective ? Oui !!! Et l’effet de groupe plus marqué pour les vaccins les plus efficaces, est moins important pour les variants moins sensibles aux vaccins. On dispose d’arguments indirects et directs. Pour les arguments indirects : on ne connait aucun vaccin dirigé contre des virus respiratoires ayant ce niveau d’efficacité qui n’exerce pas d’effet de groupe ; après une maladie COVID, les PCR sont majoritairement négatives et lorsqu’elles sont positives, les charges virales sont souvent plus faibles et l’excrétion virale moins prolongée. Pour les arguments directs :
- Quelques données préliminaires sont issues de l’étude de phase 3 du vaccin à ARNm de Moderna : une PCR a été systématiquement réalisée au moment de la deuxième dose : 39 ont été positives dans le groupe Placebo et 15 dans le groupe qui a reçu une dose de vaccin (efficacité 62%). Ce résultat est rassurant car il a été obtenu après une seule dose (la réponse immune est moins forte qu’après 2 doses. Des données similaires ont été rapportées en vie réelle pour les vaccins à ARNm et pour les autres vaccins.
- 2 semaines après une dose de vaccin à ARNm, la charge virale est, chez la minorité des sujets vaccinés mais encore positifs en PCR (asymptomatique), significativement moins importante que chez des sujets non vaccinés, suggérant une moindre contagiosité.
- En Israël, les données en vie réelle montre une protection de plus de 90% pour les formes asymptomatiques.
- Enfin une étude anglaise montre que la vaccination des professionnels de santé non seulement les protège, mais aussi de façon significative, protège leur famille.
L’existence de variants dont la contagiosité est plus élevée a pour conséquence la nécessité d’une couverture vaccinale plus élevée pour l’obtention d’une immunité de groupe. Plus une maladie est contagieuse, plus la couverture vaccinale nécessaire à l’arrêt de la circulation du virus est élevée. Pour les variants, il est estimé qu’une proportion de sujets immunisés > 80% sera nécessaire pour obtenir un effet de groupe optimal.
Une étude anglaise montre que même pour le variant ∂, le fait d’être vacciné diminue le risque de contagion et qu’il existe une relation entre l’immunogénicité des vaccins et le risque de contagiosité. Le Comirnaty® limite plus le risque de contagion à partir d’un cas index que le vaccin AstraZeneca, et le risque de contagion est minimum lorsqu’à la fois le cas index et les sujets contacts sont vaccinés par les vaccins les plus immunogènes.
Si j'ai déjà été entièrement vacciné avec le vaccin COVID-19, dois-je être mis en quarantaine si je suis sujet-contact avec une personne infectée par le SARS-CoV-2 ? Non Les recommandations d’isolement en cas d’infection par SARS-CoV-2 ou pour les cas contacts ont été changées du fait l’importance de la vague épidémique Omicron et ses conséquences sur la société : les durées ont globalement été raccourcies (tenant compte du statut vaccinal et de l’âge) la place des tests augmentée.
Comment faut-il appeler la dose proposée maintenant en plus du schéma vaccinal initial ? InfoVac préfère le terme anglo-saxon « booster » (amplificateur) à celui de 3ème dose ou de rappel pour plusieurs raisons :
- Les sujets préalablement infectés n’ont pas besoin de 3ème dose : le cumul maladie plus une dose de vaccin (à condition que le délai entre les deux soit supérieur à 3 semaines) est au moins aussi immunisant que 2 doses en primo-vaccination.
- Un schéma en 3 doses avec un espacement > 5-6 mois entre la seconde et la 3ème dose, est plus immunisant qu’avec un délai plus court.
- Le terme « rappel » tel qu’il est utilisé en français n’évoque ni la notion d’un meilleur taux d’anticorps obtenu (plus élevé qu’avec le schéma initial), ni la persistance des anticorps probablement plus longue, ni leur meilleure affinité.
- Le bon terme est celui de « booster » qui souligne bien l’effet amplificateur de la réponse immunitaire laissant augurer d’une protection plus efficace et plus prolongée.
Une étude Israélienne confirme l’excellente efficacité du booster (sur les hospitalisations et les formes sévères) comparativement au schéma vaccinal initial effectué 5 à 6 mois avant : 93% (IC95% ; 88-97).
Le rappel (booster) est-il nécessaire en période de circulation du variant Omicron ? Oui !!! Même si l’efficacité de la vaccination est médiocre vis-à-vis du variant Omicron par rapport aux VOC précédents, de nouvelles données, en provenance des USA confirment et précisent les données anglaises en vie réelle de bonne efficacité d’un schéma complet vis-à-vis des infections graves dues à ce variant (cf NL33). Une analyse rétrospective cas-contrôle (JAMA) a été conduite sur 70 000 tests réalisés chez des adultes ayant des symptômes d’infection. A partir des données vaccinales comparées entre les groupes PCR positive (N=23 000, dont 13 000 Omicron) et PCR négative (N=47 000), il apparait que le risque d’infection Omicron était 3 fois moindre parmi les personnes vaccinées avec 3 doses de vaccin ARNm (rappel réalisé à au moins 6 mois de la 2ème dose) versus 2 doses : aOR = 0,34 (IC95%, 0,32-0,36). Une autre étude de même méthodologie (Nature), focalisée sur le vaccin ARNm de Moderna et menée à partir de 27 000 PCR positives dont 84 % à Omicron a montré que l’efficacité de 2 doses contre l'infection à Omicron était de 44,0 % (IC95%, 35,1-51,6) à 14-90 jours et diminuait rapidement ensuite. L’efficacité de 3 doses était également significativement moins bonne que vis-à-vis de l’infection Delta, et évaluée à 71,6 % à 14-60 jours et 47,4 % au-delà. En termes de protection contre l’hospitalisation, l’efficacité de 2 doses était de 84,5 % (23,0-96,9) et l’efficacité de 3 doses était excellente : 99,2 % (76,3-100).
Que pensez-vous de la recommandation du comité d’orientation stratégique de pratiquer une 3ème dose de vaccin à ARNm quand le délai entre les 2 premières doses dépassait 3 mois ? Le Comité a fait cette recommandation avec des objectifs louables : d’une part, respecter les AMM (c’est avec les délais recommandés qu’ont été évaluées l’efficacité et la tolérance de ces vaccins) et d’autre part du fait de l’émergence du ∂, protéger le maximum de personnes (2 doses étant nécessaires contre ce variant). Néanmoins, aucune étude d’immunogénicité, efficacité ou tolérance n’appuie cette décision qui va à l’encontre d’une des règles fondamentales du rattrapage en vaccinologie : « toute dose effectuée compte si le délai est supérieur au délai recommandé ». InfoVac ne connait aucun exemple ou une augmentation de l’intervalle entre 2 doses diminue l’immunogénicité. De plus, cette troisième dose chez des sujets jeunes (au maximum de leur immunocompétence) n’est peut-être pas sans risque (cf risque de myocardite après la deuxième dose chez les sujets jeunes). L’application de cette nouvelle règle devrait se faire avec beaucoup de souplesse et de tolérance et concernera, nous l’espérons, peu de personnes et en particulier pas de sujet jeune.
Les couvertures vaccinales des autres vaccins sont-elles restées élevées au décours de la pandémie ? Non !!! Alors que la vaccination des nourrissons et des petits enfants a retrouvé des niveaux de couverture comparables à la période (2017-18-19) pré-pandémie, ce n’est pas le cas pour les rappels de 6 ans, 11 ans, et adultes. On constate une baisse de 15 à 20% des sorties des pharmacies (données IQVIA). Un effort de rattrapage intense devrait être mis place par les vaccinateurs et les autorités de santé.
Quels sont les enfants qui sont considérés comme à risque de COVID plus grave et à vacciner en priorité ?
La liste des pathologies impliquant un risque de forme sévère du Covid-19 et justifiant dès à présent la vaccination des enfants âgés de 5 à 11 ans concernés a été élaborée comme suit par les sociétés savantes pédiatriques en se fondant sur les données publiées.
- Cardiopathies congénitales non corrigées
- Asthmes pour lesquels il existe une nécessité de recours aux corticoïdes par voie générale, ou ayant nécessité une hospitalisation ou ALD
- Maladies hépatiques chroniques
- Maladies cardiaques et respiratoires chroniques
- Cancer en cours de traitement
- Maladie rénale chronique
- Handicap neuromusculaire sévère
- Maladies neurologiques
- Immunodéficience primitive ou secondaire (infection par le VIH ou induite par médicaments)
- Obésité
- Diabète
- Hémopathies malignes
- Drépanocytose
- Trisomie 21.
De plus, les enfants au contact de sujets immunodéprimés risquant de ne pas répondre à la vaccination sont considérés comme prioritaires.
Données de sécurité en vie réelle avec le vaccin Pfizer (Comirnaty®) Une large étude israélienne publiée dans le NEJM a comparé l’incidence de survenue de plus de 25 effets indésirables potentiellement graves à court et moyen terme, en appariant 884 828 personnes vaccinées avec Pfizer à autant de personnes non vaccinées. Le suivi était de 42 jours, répartis en 21 jours après chaque dose. Dans cette cohorte plutôt jeune (âge médian de 38 ans), le vaccin n’est pas associé à sur-risque pour la plupart des effets examinés sauf pour : la myocardite (principalement après la 2nde dose) avec un risque multiplié par 3,2, celui de lymphadénopathie multiplié par 2,4, celui d’appendicite et de zona par 1,4. Quand de nombreux effets indésirables sont étudiés dans une études cas/témoins, il n’est pas rare que des effets indésirables apparaissent comme faiblement significatifs (comme l’appendicite dans cette étude) ; cela ne correspond pas à un vrai sur-risque. Afin d’évaluer la balance Bénéfice/Risque, les auteurs ont également réalisé une analyse similaire chez des personnes infectées par le Sars-Cov2 (n=173 106), appariés à autant de personnes non infectées. Le risque chez les patients Covid est alors multiplié par 12 pour les myocardites, par 5 pour les péricardites. Le sur-risque de myocardite post-vaccination, estimé entre 1 à 5 cas pour 100 000 personnes, est donc à interpréter au regard de celui induit par la maladie, estimé entre 6 à 16 cas pour 100 000 personnes. Toutefois, cette étude ne présente pas les résultats par catégorie d’âge ce qui limite l’interprétation notamment pour les effets dont le facteur âge est impliqué (comme les myocardites ou péricardites).
Comment expliquer que les variants préoccupants sont moins sensibles aux vaccins ? Les variants préoccupants, du fait de différentes mutations, ont une conformation spatiale modifiée qui peut à la fois leur conférer plus d’affinité pour les récepteurs ACE2 et moins d’affinité pour les anticorps induits contre un virus ancestral ou un autre variant, par la vaccination ou la maladie antérieure. Ce n’est pas une « résistance » mais une diminution de sensibilité. Rappelons qu’un phénomène similaire que chacun connait déjà, avait été observé il y a plus de 40 ans pour les antibiotiques avec les pneumocoques et les ß-lactamines. En effet, des quantités d’antibiotiques plus importantes ou des molécules avec davantage d’affinité pour les récepteurs à la pénicilline avaient été nécessaires pour restaurer l’efficacité des traitements. Avant l’émergence de ces résistances, les concentrations d’antibiotiques suffisantes (CMI) pour inhiber les pneumocoques étaient très faibles (< 0,01 mg/L). Pour ces souches de sensibilité diminuée, des concentrations 10 à 100 fois supérieures étaient nécessaires. Ainsi, pour traiter efficacement ces souches moins sensibles, voire résistantes, ont été utilisés les antibiotiques dont les CMI étaient les plus basses (amoxicilline, céfotaxime-ceftriaxone). Les doses d’antibiotiques ont été augmentées (doublées, voire triplées) et le rythme d’administration a été rapproché en passant de 2 à 3 doses journalières. Il faut souligner qu’il existe de larges variations dans les CMI et les pharmacocinétiques des patients conduisent à des modèles mathématiques type « Monté-Carlo » afin de maximiser les chances de succès notamment pour les patients les plus fragiles[3]
Ce parallélisme de mécanisme de sensibilité diminuée entre les antibiotiques et les vaccins contre le SARS-CoV-2 paraît assez évident. En effet, les vaccins suscitent des anticorps contre la « Spike » des souches virales initiales, avec d’assez larges variations individuelles :
- ces anticorps ont moins d’affinité pour les variants, dont le Delta
- et on observe une baisse progressive des taux d’anticorps vaccinaux.
Un grand nombre de patients viennent avec des sérologies pour savoir quand faire le rappel. Comment les interpréter ? Si les sérologies permettaient de déterminer la protection individuelle et donc le moment d’un rappel, elles feraient partie des recommandations !
1) une sérologie ELISA n’est pas toujours corrélée avec les anticorps neutralisants ;
2) le taux d’anticorps neutralisants nécessaire à la protection n’est pas connu est très variable en fonction des variants
3) il n’y a pas de corrélation « individuelle » entre une sérologie et d’éventuels effets secondaires. Donc ni vous ni nous ne pouvons interpréter ces sérologies inutiles.
En faisant à un adolescent sa première dose de Comirnaty®, j’ai réalisé un TROD sérologique dont seul la barre « IgM » était positive et pas la barre IgG. Que faut-il en penser ? Théoriquement les IgM apparaissent 2 à 3 jours avant les IgG et il pourrait s’agir d’un début d’infection. En réalité, cette situation avec seulement des IgM correspond le plus souvent à des faux positifs et est connue pour de nombreux virus et bactéries. Si vous voulez en savoir plus, il suffit de faire une sérologie avec un dosage des anti-spike et des anti-nucléocapsides. La présence d’anticorps anti-nucléocapside de type IgG signerait une infection.
Quelles indications pour la sérologie peut-on maintenir à une période où plus de 75% des Français sont vaccinés ? Quatre indications se dégagent. La première est, avant toute vaccination ou lors de l’injection de la première dose, une sérologie anti-spike associée ou non à la sérologie anti-nucléocapside afin de ne proposer qu’une seule dose à ceux qui ont déjà fait la maladie. La seconde est une sérologie ciblant la nucléocapside si la première dose a été faite sans sérologie afin d’éviter une deuxième dose inutile notamment chez les adolescents. La troisième, pour les patients immunodéprimés (greffés ou patients sous corticoïdes, anti-TNF, immunosuppresseurs) pour approcher la réponse immunitaire. La quatrième enfin pour l’exploration ou le suivi d’un « potentiel effet indésirable ». Dans ces deux derniers cas, même si le rendu des laboratoires en BAU (Binding Antibody Units définis par l’OMS) facilite les choses, pour un suivi des taux d’anticorps chez un patient donné, il est préférable d’utiliser la même technique et dans le même laboratoire.
Faut-il faire une sérologie Covid-19 pré-vaccinale ? Au début de la pandémie une sérologie avant la vaccination n’était pas conseillée car, en population générale, le taux de positivité était faible et parce qu’en dépistage, un résultat positif avait de grande chance de correspondre à un faux positif s’il n’y avait pas d’anamnèse évocatrice de COVID 19 ou de contact étroit avec un cas avéré positif (probabilité pré-test élevée). Contrairement à l’OMS et de nombreux autres pays, la HAS conseille de réaliser une sérologie par TROD en profitant du délai de surveillance de 15’ après la première dose. Si la sérologie est positive, la deuxième dose ne sera pas nécessaire. Les arguments qui ont conduit à cette recommandation sont les suivants :
- D’après les estimations de l’Institut Pasteur, plus de 20% des personnes en France (40% dans la région parisienne) auraient une sérologie positive alors que 8 % ont eu une PCR ou des Ag positifs.
- Une dose de vaccin est suffisante pour les patients qui ont déjà fait la maladie : les taux d’anticorps obtenus après une seule dose de vaccin chez les personnes déjà infectées par la Covid-19 sont supérieurs à ceux des personnes non préalablement infectées et ayant bénéficié d’un schéma vaccinal à deux doses. Ceci permet d’une part d’économiser des doses, d’autre part d’éviter des complications liées à une hyper-immunisation.
- La vaccination croissante des adultes jeunes, voire des adolescents, augmente la probabilité d’avoir présenté des formes asymptomatiques et pauci-symptomatiques.
La HAS souligne que ce dépistage concomitant à la vaccination ne devrait pas la conditionner, ni ralentir la démarche vaccinale. Il est essentiel, avant toute généralisation de ce dépistage, de vérifier son intérêt et sa faisabilité en conditions réelles de mise en œuvre, en ville comme en centres de vaccination.
Un de mes patients de 50 ans sans antécédent, a contracté le SARS-COV-2 en Novembre 2020 (symptômes cliniques dont anosmie-agueusie et PCR positive). Un médecin a demandé en Juin 2021 une sérologie COVID qui s’est avérée négative. Faut-il lui faire 1 ou 2 doses de vaccin ? Une dose !!! Il est inutile (pour l’instant) de faire une sérologie pré-vaccinale aux personnes pour lesquelles on a la certitude de l’infection. Comme pour tous les examens, des faux négatifs existent et l’on sait, de plus, qu’une partie des sujets immunocompétents perdent leurs anticorps. Il est logique de penser que, comme pour l’hépatite B, ces patients ont tout de même une mémoire immunitaire que l’injection va « rappeler ».
La vaccination positive-t-elle la sérologie ? Oui, si les anticorps recherchés par ELISA ou immuno-chromatographie (test de diagnostic rapide) comprennent ceux de la zone de la « spike » (RDB ou S2) induits par l’injection vaccinale et si l’on est suffisamment à distance de la vaccination (2 à 3 semaines). Les laboratoires ne précisent pas toujours le type d’anticorps détectés et ce n’est généralement pas écrit dans les notices des tests de diagnostic sérologique rapide. Il semble que certains tests détectent spécifiquement les anticorps anti RDB. Il faut souligner que les méthodes de dosages ne permettent pas d’évaluer correctement la protection (anticorps neutralisants) et ne sont donc pas conseillés au décours de la vaccination. Il n’y a pas à ce jour de corrélats de protection connus entre le niveau des anticorps dosés par les sérologies COVID et la protection réelle vis à vis de la maladie. La sérologie quand elle est positive traduit le contact avec le virus.
Les sérologies après vaccin COVID pour déterminer si la réponse vaccinale est suffisante sont-elles utiles ? Non !!! Une sérologie post-vaccinale n’a (encore) pas d’utilité́ en routine. Les anticorps neutralisants sont essentiels pour éviter l’infection, mais les techniques de dosage ne sont pas standardisées et les taux protecteurs ne sont pas encore connus. La sérologie pourrait être utile si les techniques sont standardisées, pour vérifier si un sujet est immunisé. Cependant, même en l’absence d’anticorps, les lymphocytes T semblent jouer un rôle protecteur à eux seuls contre les complications.
Une patiente de 57 ans a eu la Covid-19 en juin 2020. Sa sérologie était positive avec 114 UI en juillet 2020. Comme l’indique les recommandations, elle a eu une dose d’Astra-Zeneca le 15/4/2021. Une nouvelle sérologie a été réalisée 2 mois après révélant un taux à 18 UI. Au regard de cette chute rapide des anticorps, elle a reçu une deuxième injection AZ. Je précise que ce n’est pas nous qui avons demandé ces sérologies. A-t-on eu tort, vu les recommandations de l’HAS, de ne faire qu’une seule injection ?
Cette seconde dose était très probablement inutile, mais personne ne peut répondre scientifiquement à cette question en l’absence d’étude spécifique.
En fait, il y a plusieurs éléments à prendre en compte :
- Il n’y a pas encore de méthode standardisée de dosage des anticorps. Même pour les études cliniques, chaque laboratoire producteur a développé sa propre méthode de dosages en comparant notamment les taux obtenus après vaccination à ceux observés après maladie naturelle.
L’évolution du taux d’anticorps n’a pas beaucoup de valeur à titre individuel.
- Tous les vaccins disponibles aujourd’hui sont des vaccins dirigés contre la protéine spike. Les vaccins les plus immunogènes (comparés dans les études avec les taux d’anticorps observés après maladie naturelle) sont ceux qui se sont avérés les plus efficaces à la fois sur les souches initiales et sur les variants.
- Les vaccins ne déclenchent pas uniquement la production d’anticorps ; ils suscitent une immunité cellulaire qui semble jouer un rôle majeur dans la prévention des formes graves.
- Les variants sont « moins sensibles » aux vaccins, en tous cas en ce qui concerne les formes asymptomatiques et pauci symptomatiques invitant à avoir une « bonne immunité » humorale.
Dès lors
- La sérologie, pour l’instant, ne sert qu’à déterminer si un patient a eu la COVID-19 ou s’il a été vacciné.
- La nécessité de « troisième » dose ne s’établira pas à titre individuel mais sur les notions soit de terrain particulier (immunodépression, âge…), de variants plus résistants ou de nouveaux vaccins.
- Peut-être que des seuils protecteurs seront déterminés dans les prochains mois, mais ce n’est pas encore le cas.
Un de mes patients de 50 ans sans antécédent, a contracté le SARS-COV-2 en Novembre 2020 (symptômes cliniques dont anosmie-aguesie et PCR positive). Un médecin a demandé en Juin 2021 une sérologie COVID qui s’est avérée négative. Faut-il lui faire 1 ou 2 doses de vaccin ? Une dose !!! Il est inutile (pour l’instant) de faire une sérologie pré-vaccinale aux personnes pour lesquelles on a la certitude de l’infection. Ceci car, comme pour tous les examens, des faux négatifs existent et l’on sait, de plus, qu’une partie des sujets immunocompétents perdent leurs anticorps. Il est logique de penser que, comme pour l’hépatite B, ces patients ont tout de même une mémoire immunitaire que l’injection va « rappeler ».
Que faire comme rappel à des patients vaccinés à l’étranger par une dose de vaccin Sinofarm® ? D’un pays à l’autre les recommandations changent, non pas sur des données scientifiques mais sur des textes réglementaires. Certains ne reconnaissent que les vaccins recommandés dans leur pays, les autres que ceux ayant une AMM européenne, d’autres enfin tous les vaccins reconnus par l’OMS. L’émergence des variants ß, gamma et ∂ viennent compliquer la situation : les vaccins à ARNm paraissant plus efficaces pour prévenir les infections peu sévères et la transmission. Les vaccins chinois Sinofarm®, SinoVac® ou Coronovac® sont des vaccins entiers inactivés ayant obtenu une autorisation d’utilisation d’urgence par l’OMS mais ne sont pas actuellement autorisés par l’EMA. Ainsi, ils ne permettent pas de valider les conditions d’immunisation du « passe sanitaire ». Les données d’efficacité et de tolérance sont moins bien connues que pour les autres vaccins, mais paraissent comparables aux vaccins vectorisés sur adénovirus. Il n’y a pas de donnée spécifique pour une interchangeabilité de ces vaccins avec les autres. Deux alternatives sont possibles :
- chercher une efficacité maximale en ne tenant pas compte de cette première dose et pratiquer dans les délais habituels deux doses d’un vaccin à ARNm,
- espérer une réponse « hétérologue » comme pour les vaccins vectorisés sur adénovirus, c’est plutôt l’option qui a notre préférence. En pratique, si à la 1ère dose de vaccin à ARNm la recherche d’anticorps est positive (par sérologie classique ou TROD proposé en centre de vaccination), la 2nde dose ne sera pas nécessaire.
Les réseaux sociaux ont relayé des informations concernant la fertilité et vaccins anti-Covid. Qu’en est-il ? Non !!! L’étude Presto a montré que les chances de concevoir ne sont pas réduites après la vaccination.
Puis-je me faire vacciner si je suis « sujet contact » ? Si un sujet est « contact », la vaccination doit être repoussée : un (ou plusieurs) test virologique doit être réalisé selon les recommandations pour confirmer une infection active. Nous ne disposons pas à ce jour d’étude d’efficacité de cette vaccination en post-exposition immédiate mais on n’attend pas d’effet bénéfique compte tenu de la durée d’incubation virale (5 jours en médiane) et du délai d’obtention d’une protection vaccinale (12 jours au minimum). La vaccination pourra être réalisée si le ou les tests s’avèrent négatifs. Généralement cela décale la vaccination de 7 à 14 jours.
La vaccination peut-elle rendre la PCR ou les tests antigéniques positifs ? Non !! En aucun cas. L’ARNm entre immédiatement dans les cellules et a une demi-vie très courte comme la protéine « spike ». Si ces tests sont positifs, c’est que le patient a été contaminé juste avant ou juste après la vaccination.
Les PCR et les tests antigéniques sont-ils aussi performants pour les variants Omicron ? Les nombreuses mutations de l’Omicron touchent beaucoup la spike mais aussi la nucléocapside laissant craindre une diminution des performances pour les PCR (essentiellement pour les mutations de la spike) et des tests antigéniques pour la nucléocapside . Cependant les PCR comportent l’amplification de plusieurs gènes réduisant le risque, de plus le variant Omicron comporte « seulement » 2 mutations déjà connues (R203K et G204R) que comportaient déjà le variant alpha sans conséquence évidente sur la sensibilité des tests. La FDA a cependant émis un warning et une étude suisse « in vitro » une tendance à la moindre sensibilité des tests antigéniques. Il n’existe pour l’instant aucune étude évaluant la sensibilité des tests sur le terrain.
Les vaccins AstraZeneca ou Johnson et Johnson augmentent-t-ils le risque de thrombose ? Ces vaccins ne sont pas associés à une augmentation globale du risque d'événements thromboemboliques notamment des phlébites et embolies pulmonaires qui en sont les deux manifestations les plus fréquentes, mais à un risque d’accidents thrombo-emboliques atypiques mais graves. En effet, plusieurs descriptions de malades présentant un syndrome caractérisé par des thromboses atypiques et une thrombopénie ont été rapportées une à trois semaines après la première dose du vaccin AstraZeneca ) (AZ) puis Johnson&Johnson (JJ). L’immense majorité des patients étaient en bonne santé et ne présentaient pas de facteur de risque connu. La plupart des patients étaient des femmes de moins de 50 ans, dont certaines recevaient des contraceptifs oraux. Ces thromboses atypiques touchaient des sites inhabituels, notamment les sinus veineux cérébraux (TVC), les veines splanchniques (TVS) hépatiques ou porte. Au moment du diagnostic, une thrombopénie nette (10 000 à 110 000/mm3) était retrouvée. De plus, des taux élevés de d-dimères et de faibles taux de fibrinogène étaient fréquents suggérant une consommation. L’association de thrombose et de thrombopénie a fait penser au tableau de thrombopénie induite par l'héparine (TIH) mais aucun des patients n’en avait reçu. Bien que la pathogénie de ce syndrome de thrombose-thrombopénie induite par la vaccination (TTIV) ne soit pas encore élucidée, certains résultats plaident pour un mécanisme proche du TIH. En effet, chez presque tous les patients, des taux élevés d'anticorps contre les complexes facteurs 4 (FP4) ont été retrouvés par ELISA et par des tests d'activation plaquettaire. Contrairement au TIH, la liaison des anticorps au FP4 s'est produite en l'absence d'héparine et la distribution des thromboses diffère clairement. Aucun signal n'avait été détecté lors des essais cliniques (comportant plusieurs dizaines de milliers de patients) et ayant conduit à l'approbation des vaccins AZ et JJ). L'Agence européenne des médicaments (l’Europe, qui a le plus utilisé le vaccin AZ et disposant d’un système de pharmacovigilance efficace) a répertorié 231 cas possibles (169 cas de TVC et 53 cas TVS) chez 34 millions de personnes ayant reçu le vaccin AZ soit une incidence < 1 cas pour 100 .000 vaccinés. Ce chiffre doit être considéré dans le contexte de l'incidence annuelle de la TVC dans la population générale (environ 1 cas pour 100 000 par an). Pour le vaccin JJ principalement utilisé aux Etats-Unis, le C.D.C. a retrouvé 28 cas sur près de 10 millions de vaccinés : l’immense majorité des cas (22/28) concernent des femmes, 18 d’entre elles avaient moins de 50 ans. Le risque global de développer un TTIV est extrêmement faible paraissant inférieur au vaccin AZ : 1/300.000 au global, environ 1 cas/100.000 chez les femmes âgées de 18 à 49 ans. Les informations disponibles suggèrent que les immunoglobulines IV et les glucocorticoïdes à fortes doses peuvent améliorer la thrombopénie en quelques jours et que l’utilisation d’autres anticoagulants que l’héparine est conseillée.
Ces observations soulèvent des questions importantes ayant des implications cliniques.
1) Quel(s) composant(s) du vaccin (séquences de l’adénovirus exprimées, spike ou autre composant) suscitent une réponse à une protéine hôte apparemment sans rapport, la PF4 ?
2) Quel est le risque après une re-vaccination ?
4) Les anticorps anti-VITT ressemblent t’ils aux anticorps anti-PF4 présents après une infection par le SRAS-CoV-2, qui ont été décrits chez des patients présentant une TIH ?
6) La distribution atypique des thromboses est-elle liée à la localisation de l'antigène ou à la réponse vasculaire ?
Il faut rappeler la très faible prévalence (1/100.000 à 1/1.000.000 en fonction de l’âge, du sexe et des vaccins) de cette complication de la vaccination, aussi sévère soit-elle, par rapport aux bénéfices de prévention de la Covid-19 (mortalité de 0,5 à 2 %) qui peut laisser des séquelles à long terme. Néanmoins, ces TTIV justifient d’être vigilant lorsque des patients présentent des symptômes neurologiques ou des abdominaux après l’administration d’un vaccin contre le SRAS-CoV-2.
Un algorithme de prise en charge (sous l’égide de SFNV, SFMV et GFHT) est disponible. Les signes qui doivent faire consulter : maux de tête, douleurs abdominales, nausées ou vomissements persistant plus de 3 jours ou s’intensifiant, troubles visuels, signes respiratoires ou purpura (https://ansm.sante.fr). L’OMS comme l’EMA ne remettent cependant pas en cause le rapport bénéfice/risque de ce vaccin. La France comme de nombreux pays européens maintenant, réserve l’utilisation du vaccin AZ ou J&J chez les personnes de 55 ans et plus. Il est recommandé aux personnes de moins de 55 ans ayant reçu une 1ère dose de vaccin AZ, de recevoir en rappel, un vaccin à ARNm. Bien qu’utilisant des technologies différentes, ces deux types de vaccin conduisent à la production de la même protéine, la protéine S, contre laquelle est dirigée la réponse immunitaire protégeant contre la Covid-19.
Que sait-on de la tolérance des vaccins chez les personnes préalablement infectées par le SARS-CoV-2 ? Aussi bien dans les études cliniques précédant l’AMM que sur données de pharmacovigilance il n’y a aucun d’incident grave décrit, mais une réactogénicité plus importante a été rapportée.
Que savons-nous de la sécurité à long terme des vaccins contre la COVID-19 ? Le suivi de la sécurité de ces vaccins est le même que pour tous les autres. Les essais de phase 3 chez l'adulte prévoient un suivi de deux ans de leur cohorte de sujets inclus, ce qui est plus long que pour la plupart des vaccins en cours de développement. Certes, Il est impossible de connaître le profil de sécurité à très long terme de vaccins qui n'ont été administrés à l'homme que depuis environ 6 mois. Cela dit, à ce jour, aucun vaccin ne s'est avéré présenter un problème de sécurité inattendu à long terme qui n'ait été découvert que des années ou des décennies après son introduction. La durée de surveillance des essais cliniques au-delà de 6 mois sert autant à permettre d’infirmer qu’à démontrer la responsabilité du vaccin étudié dans la survenue de tel événement indésirable.
J’entends de plus en plus souvent parler d’une troisième dose de vaccin contre la COVID-19. Que faut-il en penser ? L’administration d’une 3ème dose pourrait s’envisager dans quatre situations différentes. La première, effective dès maintenant, est celle des sujets immunodéprimés profonds (greffés, CD20…) qui doivent recevoir la troisième injection au moins 1 mois après la deuxième dose. De même, les sujets de plus de 80 ans, notamment en EHPAD, et qui ont été vaccinés dès le début d’année 2021 peuvent dès maintenant bénéficier d’une troisième dose qui agirait cette fois comme un rappel. La deuxième situation est de proposer une 3ème dose aux personnes âgées de plus de 65 ans ou à risque de COVID-19 qui ont une réponse immunitaire moins forte, afin d’augmenter leur taux d’anticorps dans un contexte de généralisation de variants moins sensibles aux vaccins. La troisième situation envisageable serait de proposer les vaccins actuels 6 mois après la deuxième dose en population générale, pour les mêmes raisons et pour diminuer la circulation des variants. Pour l’instant la HAS n’est favorable à l’administration d’un rappel pour les sujets moins de 65 ans, uniquement pour les soignants.
Avancer la troisième dose as-t-il des inconvénients ? Possiblement OUI, mais il a aussi des avantages. Pour les vaccins non vivants connus (diphtérie, tétanos, Polio, hépatite B, pneumocoque…), l’effet « booster » maximal (forte augmentation des titres anticorps, allongement de la persistance des anticorps et amélioration de l’affinité de ceux-ci pour les antigènes) était obtenu après un délai minimal de 5 à 6 mois. Avec l’arrivée des variants Omicron et la forte augmentation de l’efficacité après la 3ème dose effectuée dès 3 mois après la 2ème dose, de nombreux pays ont réduit le délai entre le deuxième et la troisième dose à 3 mois pour réduire le poids de la vague « omicron ». D’autres comme la Suisse ne souhaite pas descendre le délai en dessous de 4 mois. La HAS c’est prononcé pour un délai de 3 mois en précisant que c’est pour des raisons épidémiologiques et le gouvernement l’a suivi ces derniers jours.
Une patiente a fait un urticaire dans les heures suivant sa première dose de vaccin. Faut-il interrompre la vaccination ? Non, cela n’augmente pas le risque de choc anaphylactique à une dose suivante. Pour le confort et rassurer tout le monde, un simple antihistaminique per os pendant 48h dès le matin de la vaccination suffira !
Quel vaccin en rappel à des patients vaccinés à l’étranger par des vaccins non enregistrés en Europe ? D’un pays à l’autre, les recommandations changent, non pas sur des données scientifiques mais sur des textes réglementaires. Certains ne reconnaissent que les vaccins recommandés dans leur pays, d’autres, uniquement ceux ayant une AMM européenne, et d’autres enfin tous les vaccins reconnus par l’OMS. L’émergence des variants ß, et ∂ vient compliquer la situation : les vaccins à ARNm paraissant plus efficaces pour prévenir les infections peu sévères et la transmission. Les vaccins chinois Sinofarm® ou SinoVac® sont des vaccins entiers inactivés ayant obtenu une autorisation d’utilisation d’urgence par l’OMS mais n’ont pas encore été autorisés par l’EMA. Les données d’efficacité et de tolérance sont moins bien connues que pour les autres vaccins, mais paraissent comparables aux vaccins vectorisés sur adénovirus. Il n’y a pas de donnée spécifique pour une interchangeabilité de ces vaccins avec les autres. Le vaccin Sputnik V est un vaccin vectorisé sur deux adénovirus humains modifiés non-répliquant : adénovirus 26 pour la première dose (comme le vaccin Johnson&Jonhson) et adénovirus 5 pour la deuxième afin d’éviter un éventuel effet « blunting ». Ils ne sont pas encore approuvés ni par l’agence européenne ni par l’OMS. Les données d’efficacité publiées dans le Lancet sont excellentes. Il n’y a pas de donnée spécifique pour une interchangeabilité de ce vaccin avec les autres. Les données dont nous disposons pour le vaccin AstraZeneca (lui aussi vectorisé sur un adénovirus) suivi d’un vaccin à ARNm deux mois après laissent penser qu’une seule dose de vaccin à ARNm sera suffisante.
Ces différents vaccins ne permettent pas de valider les conditions d’immunisation du « passe sanitaire ». La solution la plus raisonnable nous parait être la suivante : que les patients aient reçu une dose ou 2 doses d’un vaccin non enregistré, faire une sérologie au moment de l’injection de la première dose. Si elle est positive, une seule dose de vaccin à ARNm est nécessaire ; si elle est négative, il vaut mieux programmer 2 doses.
Cette attitude s’appuie sur le fait que les schémas hétérologues fonctionnent bien, que le variant ∂ est devenu prédominant et que les vaccins ARNm sont plus efficaces sur les variants.
En outre, elle respecte les recommandations officielles (sérologie + = une dose) et permet l’obtention du passe sanitaire.
Doit-on s’inquiéter de l’émergence de nouvelles souches ? Oui !!! Mais il ne faut pas céder à la panique « médiatique » concernant les variants. La situation épidémiologique est marquée dans le monde par l’émergence de nombreux variants préoccupants (VOC ou Variant of Concern). Comme de nombreux virus, le SARS-CoV-2 mute en permanence. Il s’agit d’erreurs de lecture de l’acide nucléique, le plus souvent sans conséquence, mais qui parfois peuvent apporter un avantage écologique au virus. Une mutation déjà ancienne sur la protéine « spike » (G- 614 au lieu de D-614) avait déjà conféré, une plus grande transmissibilité aux souches circulantes en occident comparativement à la souche originelle chinoise. Un variant est un sous-type de virus dont le génome diffère par plusieurs mutations par rapport au virus de référence qui modifient ses propriétés biologiques. Les VOC sont ceux qui entrainent une plus grande transmissibilité et/ou une plus grande gravité et/ou une résistance au vaccin et/ou une modification des performances des tests permettant le diagnostic. Une lignée est un ensemble de virus descendants d’une même souche ancestrale. Ce qu’il faut bien comprendre c’est que les mutations se produisent d’autant plus que la circulation virale est intense, prolongée et probablement que les populations affectées ont une immunité moins bonne. Ces variants comportent tous de multiples mutations mais les plus marquantes concernent la protéine de pointe ou spike modifiant sa forme et lui conférant une plus forte affinité sur le récepteur ACE2 (la clé rentre mieux dans la serrure) avec pour conséquence plus de cellules infectées et des charges virales plus élevées responsables :
- d’une plus grande transmissibilité : c’est la règle pour tous ces variants et c’est l’avantage écologique principal en l’absence de vaccination. Les sujets infectés sont plus infectants et sur des périodes plus prolongées, d’où l’allongement des périodes d’isolement imposées.
- d’une plus grande gravité : les études donnent des résultats contradictoires, mais il est logique de le penser en présence de charges virales plus élevées.
- d’un échappement à l’immunité acquise soit par la maladie naturelle liée à un virus initial, soit par la vaccination, mais les données sont très parcellaires. Il est cependant logique de penser que la conjonction d’une réplication virale intense du fait d’un pic épidémique et d’une immunité de groupe partielle risque de sélectionner des variants plus ou moins résistants à l’immunité.
De très nombreux variants ont été rapportés dans le monde, mais ils convergent, en termes de mutations de la protéine S, vers quelques lignées se ressemblant beaucoup et 4 d’entre eux sont sous surveillance renforcée. Après le variant anglais devenu prédominant en Europe, et les variants sud-africain, brésiliens et indien, un variant centre-africain (B.1.620) est venu s’ajouter ces derniers jours. Chacun d’eux est impliqué dans les grandes vagues épidémiques. Certes, le non-respect des gestes barrières sur la durée, l’utilisation pour le moins non optimale des tests diagnostiques et surtout les conclusions et attitudes à adopter en cas de positivité, des campagnes de vaccination trop lentes, ont sans nul doute un rôle important dans l’émergence de ces rebonds successifs. A l’heure actuelle, la lutte contre la pandémie ne peut se dispenser d’aucune de ces mesures.
En France, alors que les variants sud-africain et brésiliens ont été isolés depuis plusieurs mois, leurs proportions parmi les souches isolées n’ont pas augmenté de façon significative et le variant anglais est resté prédominant, témoignant probablement d’une plus grande transmissibilité. La pression de sélection vaccinale pourrait changer la situation. Cependant, une vision cataclysmique des variants qui viendraient empêcher un contrôle de l’épidémie est inutile, contre-productive et n’est pas le scénario le plus probable. En effet, le SARS-CoV-2 a un répertoire de mutations relativement limité. Le répertoire des mutations montre que de mêmes mutations concernant la protéine S apparaissent partout dans le monde mais dans des ordres différents.
Une étude cas-témoins récente au Qatar, où le vaccin Pfizer-BioNTech a été largement utilisé et où prédominaient les variants britannique et sud-africain, a permis d’évaluer de façon fine, l’efficacité sur ces souches : 89,5 % (IC95% 85,9–92,3) sur les infections à variant dit « britannique», 75 % (IC95% 70,5–78,9) sur les infections à variant dit « sud-africain » et 100 % (IC95% 81,7–100 ou 73,7-100) sur les Covid-19 graves (sévères, critiques ou fatales) pour ces deux variants.
Enfin, la technologie des vaccins à ARN messager peut permettre de les adapter très rapidement. L'idée est de surveiller les nouveaux variants, d'identifier les mutations préoccupantes afin de les introduire dans ces vaccins pour fabriquer une dose de rappel. Moderna par exemple, a annoncé qu’une 3ème dose de son vaccin spécifiquement dirigée contre le variant sud-africain permettait l’obtention de taux d'anticorps élevés dirigés contre les variants brésilien et sud-africain alors qu’il était craint qu’un rappel par un « vaccin de 2ème génération » induise une montée du taux des anticorps dirigés contre l’antigène du 1er vaccin (hypothèse dite du « pécher originel ». Cette firme s’oriente aussi vers la mise au point de vaccins comportant 2 ARNm différents pour élargir le spectre de protection.
La conséquence majeure de variants plus transmissibles est l’augmentation du R0 à La proportion de gens immunisés, nécessaire pour obtenir un effet de groupe (1-1/R0), passe de 60-70% à > 80%.
Il faut bien intégrer plusieurs données en apparence contradictoires :
- La vaccination associée aux autres mesures, en empêchant l’infection ou en réduisant le nombre de cas est la meilleure façon de limiter la réplication virale donc les mutations et l’émergence de variants.
- Certains variants sont sur-représentés dans les échecs de vaccination, alors que les vaccins gardent une activité très significative contre ces variants : ceci témoigne d’un échappement partiel à l’immunité vaccinale.
- Même si des clusters surviennent, la gravité des cas cliniques semble moindre ?
- Il n’est pas exclu que la vaccination puisse exercer une pression de sélection permettant aux variants résistants aux vaccins de prospérer. L’immunité de groupe obtenue uniquement par l’acquisition de la maladie par une proportion importante de la population est peu probable du fait de l’émergence de variants et d’une durée relativement brève de l’immunité chez une proportion des infectés. La vaccination avec des vaccins adaptés aux variants sera très probablement nécessaire. Les fabricants de vaccins ont annoncé qu’ils étaient capables d’adapter leurs produits aux souches circulantes en quelques semaines, voire de produire des vaccins couvrant l’ensemble des variants existants.
Le variant anglais est-il plus dangereux que les souches circulantes antérieurement ?
Le variant anglais présente en plus une mutation dans le domaine de liaison au récepteur de la protéine S en position 501 (acide aminé « asparagine » remplacé par la « tyrosine »), ainsi que plusieurs autres mutations et délétions (8 sur la Spike et une dizaine sur d’autres protéines). Ce variant comme le variant sud-africain est clairement, à tout âge, plus transmissible (>1,4 à 1,8 fois plus que les premiers SARS-CoV-2) et il a progressivement supplanter les autres en Europe, Israël… du fait de cet avantage écologique. En France il a été prédominant de Février à Juin 2021, puis remplacé par le variant ∂, 1,6 fois plus contagieux et un peu plus « résistant » aux vaccins pour les formes communes mais pas pour les formes graves.
Doit-on s’inquiéter de l’émergence du variant brésilien ou γ ? Oui !!! Car ce variant ( ou P.1) est plus transmissible et semble plus virulent. Mais les données sur la transmission, la sévérité des manifestations cliniques, les réinfections, l’efficacité des vaccins et des anticorps monoclonaux sont limitées. En raison de mutations partagées avec le variant sud-africain, une diminution de l’efficacité des vaccins est anticipée mais non démontrée.
Doit-on s’inquiéter de l’émergence du variant sud-africain ou ß ? Oui !!! Ce variant B.1.351 est 1,5 fois plus transmissible que les souches circulantes auparavant (et aussi contagieux que le variant alpha. Ce variant ß est celui qui est le moins sensible « in vitro » aux anticorps neutralisants du plasma de convalescents pour la COVID-19 ou de vaccinés. Il soulève donc des inquiétudes quant aux risques accrus de réinfection. Il semble cependant que l’immunité cellulaire soit moins touchée. Concernant les vaccins,
- Pour l’AZ, les résultats semblent discordants : pas efficace en Afrique du Sud sur les formes bénignes, plus efficace en Angleterre sur les formes graves.
- Pour le Pfizer-BioNTech, une partie de l’étude pivot a été faite en Afrique du Sud avec un résultat satisfaisant, comme au Qatar (75% d’efficacité sur les formes communes, plus de 90% pour les formes graves).
- Pour les vaccins Johnson et Johnson et Novavax, une baisse de l’efficacité clinique a été notée mais n’atteint pas la significativité.
Des essais cliniques visant à tester l’efficacité́ d’une troisième dose ou de vaccins développés spécifiquement contre ces variants ont été annoncés par les fabricants Pfizer-BioNTech et Moderna.
Faut-il s’inquiéter des variants indiens ou ∂ ? La réponse est OUI. Les variants dits "indiens" appelés maintenant sont désormais les plus préoccupants parce qu’ils associent une transmissibilité sans précédent et un certain degré de résistance à l’immunité acquise par la maladie antérieure ou la vaccination. Plusieurs variants ont émergé en Inde à partir d’octobre 2020. Appartenant au lignage B.1.617 (divisé en 3 sous-lignages B.1.617.1/2/3 et autrement désigné 20A/452R.V3), ils représentent maintenant la majorité des souches circulantes dans le Monde et la reprise épidémique est clairement liée à ces variants. Ils ont en commun les mutations D614G, L452R et P681R dans la protéine S, les 2 premières augmentant l’affinité du virus pour le récepteur des cellules hôtes, ACE2, et la 3ème semblant faciliter la fusion entre le virus et la cellule hôte. Ces mutations expliquent ainsi la transmissibilité augmentée de ces variants. Des études récentes montrent que la charge virale en cas d’infection avec le variant ∂ est 100 à 1000 fois plus élevée que celle qui était observée avec les souches initiales : le R0 est passé de 2,5-3 à > 6 expliquant la brutalité de la reprise épidémique et la multiplication des situations d’hyper contamination. Les variants ∂ portent en outre la mutation E484Q, proche de la mutation E484K responsable de l’échappement immunitaire relatif des variants dits « sud-africain » et « brésilien ». Pour autant, plusieurs études disponibles montrent que l’impact de ces mutations sur le pouvoir neutralisant des anticorps générés par une ancienne infection ou par les vaccins ARN est moindre que ce qui est observé avec les variants dits « sud-africain » et « brésilien ». On pouvait donc espérer que l’impact des variants ∂ serait limité en termes d’échappement immunitaire. Ceci a été confirmé par une étude d’efficacité en vie réelle en Angleterre qui montre cependant que deux doses de vaccins sont nécessaires pour assurer une bonne protection (contre l’ensemble des formes symptomatiques (88% pour le vaccin Pfizer, 66% pour AstraZeneca). Cette activité en grande partie conservée des vaccins, explique que la majorité des cas surviennent chez des sujets non vaccinés, plus rarement chez ceux qui n’ont reçu qu’une seule dose. Aux USA ou le variant ∂ prédomine aussi, plus de 90 % des cas et des hospitalisations pour Covid-19 sont chez des non vaccinés, d’où l’expression de la directrice du CDC : « pandémie des non vaccinés ». Face à l’émergence de ce variant, la HAS recommande de privilégier la vaccination par les vaccins ARNm (Moderna ou Pfizer), permettant de réduire la durée de l’intervalle à 3-4 semaines entre les 2 doses et, compte tenu des données maintenant disponibles, de proposer de faire la 2e dose avec un vaccin ARNm aux personnes ayant reçu le vaccin d’AZ en 1ère dose, dès la 4ème semaine, y compris chez les plus de 55 ans. Des échecs de vaccination après deux doses surviennent cependant, les formes graves n’étant cependant rapportées que chez des sujets âgés (> 80 ans) ou immunodéprimés. Ces variants donnent-ils des formes plus graves ? Les données sont discordantes : la charge virale élevée et les modèles animaux le laissent craindre. Ces derniers montrent que les lésions pulmonaires induites par ces variants sont plus sévères, mais ceci n’est pas directement extrapolable à l’homme. Des données du Royaume-Uni montrent un risque de développer une forme sévère augmenté d’un facteur 2 en cas d’infection par le variant delta comparativement au variant alpha. A contrario, en Angleterre, en Israël et en France il y a une dissociation entre le nombre de cas rapidement croissant et la charge hospitalière (encore) relativement modeste. Ceci s’explique largement par le fait que le virus touche essentiellement des sujets jeunes (> 50 % ont entre 12 et 30 ans) pas ou moins bien vaccinés que les sujets plus âgés. Enfin, ces variants n’impactent pas les résultats des tests de diagnostic. Au contraire, vue l’importance de la charge virale, on peut penser que les tests antigéniques sont encore plus sensibles.
Initialement détecté en Colombie (janvier 2021), il partage 3 mutations de la Spike, présentes chez les variants alpha, beta, delta. La principale crainte qu’il inspire, émane de ses capacités d’évasion vis-à-vis de la neutralisation par les anticorps proches du variant ß. Sa compétitivité relative vis-à-vis de Delta demeure inconnue mais dans les pays où Delta prédomine, il ne semble pas diffuser de façon significative, malgré des introductions répétées. Il n’y a pas de données disponibles concernant l’impact sur la sévérité. En Europe il n’a fait l’objet que de détection sporadique (0,1%), en France notamment il n’a circulé qu’à très bas bruit circulation (161 détections depuis mai 2021).
Les variants inquiétants sont-ils plus transmissibles chez l’enfant que chez l’adulte ? Non !!! Jusqu’aux variants ∂, ils étaient plus contagieux à tout âge et les enfants infectés avec les variants étaient donc plus contagieux que ceux qui l’étaient avec les souches initiales, mais restaient tout de même moins contagieux que les adultes. Cependant le fait qu’une proportion importante d’adultes soient maintenant vaccinés sans que les adolescents ou les enfants le soient, risque de transformer la COVID-19 en une maladie pédiatrique dans les pays ayant un accès large aux vaccins. Pour Omicron, la transmissibilité apparait comme comparable chez l’adulte que chez l’enfant.
Avoir eu un zona est-il un facteur de risque de réactivation après vaccination COVID-19 justifiant un certificat médical de contre-indication ? Non ce n’est pas une contre-indication, bien qu’une étude ait relevé un risque augmenté de réactivation de zona (+40%, soit + 15.8 cas sur 100'000, CI95% 8.2-24.2). En effet, ces réactivations sont observées dans les groupes d’âge où le bénéfice de la vaccination l’emporte largement sur celui d’un épisode de zona pouvant être traité par un traitement antiviral précoce.
Un patient a fait un zona après sa 2ème dose. Faut-il le vacciner contre le zona avant le rappel ? Non : un épisode de zona réactive fortement l’immunité, donc pas de crainte de récidive.
Robert Cohen, Maeva Lefebvre, Odile Launay, Didier Pinquier, Isabelle Hau, Catherine Weil-Olivier, Pierre Bégué, Pierre Bakhache, Marie-Aliette Dommergues, Véronique Dufour, Joël Gaudelus, Hervé Haas, Olivier Romain, Georges Thiebault, François Vie le Sage, Claire-Anne Siegrist.
CONTACT | SITEMAP | MENTIONS LÉGALES | 2007-2025 © InfoVac. Tous droits réservés
Ce site utilise Google Analytics pour analyser l'audience du site et améliorer son contenu. Pour plus d'information sur les règles de confidentialité relatives à l'utilisation de Google Analytics, cliquez ici
Pour plus de détails sur vos droits et notre politique de confidentialité, cliquez ici.